Слайды и текст этой онлайн презентации
Слайд 1
Проект по биологии на тему: «Вода – основа жизни:
Слайд 2
Вода.
Тяжёлая вода
Содержание
Слайд 3
Вода – оксид водорода – одно из наиболее распространённых и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, - она всегда содержит примеси. Получают чистую воду методом перегонки. Состав воды (по массе): 11,19% водорода и 88,81% кислорода.
Физические свойства. Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0°С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лёд всплывает на поверхность. Вода замерзает при 0°С и кипит при 100°С при давлении 101 325 па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода – хороший растворитель.
Слайд 4
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы. В жидкой воде наряду с обычными молекулами Н2О содержатся ассоцированные молекулы, т.е. соединённые в более сложные агрегаты (Н2О)х, благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии её физических свойств; максимальная плотность при 4°С, высокая температура кипения (в ряду Н2О – Н2S – Н2Se – H2Se – H2Te), аномально высокая теплоёмкость [4,18 кДж/(г·К]. С повышением температуры водородные связи разрываются, и полный разрыв их наступает при переходе воды в пар.
Слайд 5
Химические свойства. Вода – весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щёлочными и щёлочно-земельными металлами, например,
Н2О + Na2O = 2NaOH
H2O + SO2 = H2SO3
2H2O + Li = 2LiOH + H2↑
2H2O + Ca = Ca(OH)2 + H2↑
вода образует многочисленные соединения – гидраты (кристаллогидраты). Например,
H2O + H2SO4 = H2SO4 · H2O
H2O + NaOH = NaOH · H2O
10H2O + Na2CO3 = Na2CO3 · 10H2O
5H2O + CuSO4 = CuSO4 · 5H2O
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. из других осушающих веществ можно указать P2O5, CaO, BaO, металлический Na (они тоже химически взаимодействуют с водой), а также силикагель.
Слайд 6
Вода, содержащая тяжёлый водород,
называется тяжёлой водой (обозначается
формулой D2O). Как это видно из
сопостановления физических свойств, она
отличается от обычной воды:
Тяжёлая вода
Слайд 7
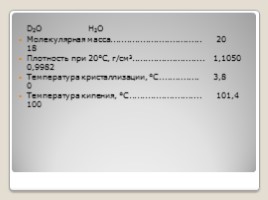
D2O H2O
Молекулярная масса.................................. 20 18
Плотность при 20°С, г/см3........................... 1,1050 0,9982
Температура кристаллизации, °С............... 3,8 0
Температура кипения, °С........................... 101,4 100
Слайд 8
Химические реакции с тяжёлой водой протекают значительно медленнее, чем с обычной водой. Поэтому она при длительном электролизе обычной воды накапливается в электролизере.
Тяжёлая вода применяется в качестве замедлителя нейтронов в ядерных реакторах.
Слайд 9
Литература:
«Природный пакет». Комитет по природопользованию, охране окружающей среды и обеспечению экологической безопасности Санкт-Петербург.
«Химия» и «Общество» под редакцией М. Ю. Гололобова, М. Г. Гольдфельда.
Книга для чтении по неорганической химии. Составитель В. А. Крицман.
«ЭКОЛОГИЯ ПОДМОСКОВЬЯ» . Е. В. Брызгалина и др.
Пособие по химии (для поступающих в ВУЗы). Г. П. Хомченко.
 Проектная работа «Вода - источник жизни»
Проектная работа «Вода - источник жизни» Учебный проект «Aизическая культура – основа жизни»
Учебный проект «Aизическая культура – основа жизни» Мкоу мамонтовская основная школа. Научно-исследовательский проект на тему «Опасен ли бытовой мусор для окружающей среды»
Мкоу мамонтовская основная школа. Научно-исследовательский проект на тему «Опасен ли бытовой мусор для окружающей среды» Вода – основа жизни
Вода – основа жизни Проект «Пуговица в нашей жизни»
Проект «Пуговица в нашей жизни» Основы учебно-исследовательской и проектной деятельности
Основы учебно-исследовательской и проектной деятельности Проект на тему «Рифма»
Проект на тему «Рифма»