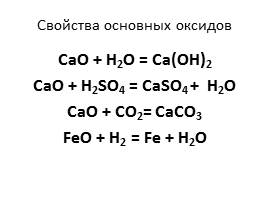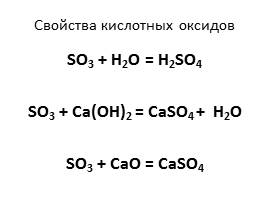Слайды и текст этой онлайн презентации
Слайд 1
Свойства оксидов и оснований
Слайд 2
Цели учебного занятия:
Образовательная: обобщить и систематизи-ровать знания о классификации веществ; показать зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева и строения атома.
Развивающая: развивать умение применять теоретические знания при выполнении практических заданий.
Воспитательная: воспитывать интерес к дисциплине; воспитывать аккуратность и внимательность.
Слайд 3
Знать: классификацию и номенклатуру оксидов и оснований.
Уметь: определять: принадлежность веществ к оксидам и основаниям; типы реакций; характеризовать: общие химические свойства оксидов и оснований.
Иметь практический опыт: проведения химического эксперимента по распознаванию оксидов и оснований, получению конкретных веществ, относящихся к изученным классам соединений; проведения расчетов по химическим формулам и уравнениям химических реакций.
Слайд 5
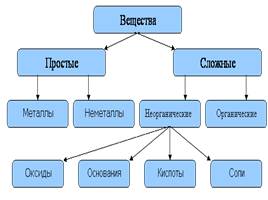
Оксиды
соединения, образованные атомами двух элементов, одним из которых является кислород в степени окисления (– 2)
«оксид» + «какого элемента?» (переменная степень окисления)
MgO - оксид магния
SO3 - оксид серы (VI)
Слайд 6
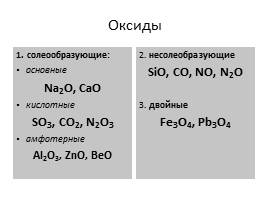
Оксиды
1. солеообразующие:
основные
Na2O, CaO
кислотные
SO3, CO2, N2O3
амфотерные
Al2O3, ZnO, BeO
2. несолеобразующие
SiO, CO, NO, N2O
3. двойные
Fe3O4, Pb3O4
Слайд 8
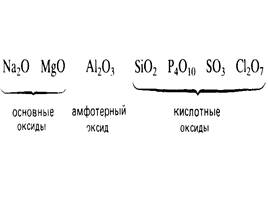
Основные оксиды
– оксиды всех металлов главной подгруппы первой группы (щелочные металлы Li – Fr)
– главной подгруппы второй группы, начиная с магния (Mg – Ra)
– оксиды переходных металлов в низших степенях окисления (MnO, FeO)
Слайд 9
Свойства основных оксидов
1. основный оксид + вода растворимое основание
2. основный оксид + кислота соль + вода
3. основный оксид + кислотный оксид соль
4. основный оксид + водород металл + вода ( искл. оксиды раствор. оснований)
Слайд 10
Свойства основных оксидов
CaO + H2O = Ca(OH)2
CaO + H2SO4 = CaSO4 + H2O
CaO + CO2= CaCO3
FeO + H2 = Fe + H2O
Слайд 11
Кислотные оксиды
оксиды металлов от +4 до +7
оксиды неметаллов
Слайд 12
Свойства кислотных оксидов
1. кислотный оксид + вода кислота (искл. SiO2)
2. кислотный оксид + растворимое основание соль + вода
3. кислотный оксид + основный оксид соль
Слайд 13
Свойства кислотных оксидов
SO3 + H2O = H2SO4
SO3 + Ca(OH)2 = CaSO4 + H2O
SO3 + CaO = CaSO4
Слайд 14
Амфотерные оксиды
оксиды, способные проявлять как кислотные, так и основные свойства, в зависимости от свойств второго реагента, участвующего в реакции
реагируя с сильной кислотой или кислотным оксидом, проявляет свойства основного оксида
при взаимодействии с сильным основанием или основным оксидом – свойства кислотного оксида
Слайд 15
Амфотерные оксиды
как основный оксид
ZnO + SO3 = ZnSO4
как кислотный оксид
ZnO + CaO = CaZnO2
Слайд 16
Основания
электролиты, при диссоциации которых образуется катион металла и анион гидроксогруппы
«гидроксид» + какого металла? + (переменная степень окисления)
NaOH – гидроксид натрия
Fe(OH)2 - гидроксид железа (II)
Слайд 17
Основания
по кислотности:
однокислотные
NaOH
двухкислотные Ca(OH)2
трехкислотные Fe(OH) 3
2.по растворимости:
растворимые (щелочи)
малорастворимые
нерастворимые
Слайд 18
Свойства растворимых оснований
1. растворимое основание + кислотный оксид соль + вода
2. растворимое основание + кислота соль + вода
3. растворимое основание + соль1 нерастворимое основание + соль2
а) соль1 растворима
Слайд 19
Свойства растворимых оснований
2 NaOH + SiO2 = Na2SiO3 + H2O
NaOH + HCl = NaCl + H2O
2 NaOH + FeCl2 = Fe(OH)2 + 2 NaCl
Слайд 20
Свойства нерастворимых оснований
нерастворимое основание + кислота соль + вода
нерастворимое основание при нагревании оксид металла + вода
Слайд 21
Свойства нерастворимых оснований
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
Cu(OH)2 = CuO + 2 H2O
 Тема урока: «Основания, их классификация и свойства».
Тема урока: «Основания, их классификация и свойства». Оксиды. Химические свойства оксидов
Оксиды. Химические свойства оксидов Основания. Химические свойства
Основания. Химические свойства Основание Воронежа
Основание Воронежа Белки (свойства и функции)
Белки (свойства и функции) Основные направления работы по обеспечению двигательной активности на логопедических занятиях на основании технологии В.Г.Алямовской. М.Н. Чернышова
Основные направления работы по обеспечению двигательной активности на логопедических занятиях на основании технологии В.Г.Алямовской. М.Н. Чернышова Сочетательное свойство умножения
Сочетательное свойство умножения