Слайды и текст этой онлайн презентации
Слайд 1
Основания. Химические свойства.
Слайд 2
Основания (гидроксиды)
– это сложные вещества, состоящие из ионов металла и связанных с ними гидроксильных групп.
ОН-гидроксильная группа
Слайд 3
Валентность гидроксогруппы –
Количество гидроксогрупп определяется валентностью
металла,
образующего основание.
Слайд 4
Название оснований
Гидроксид
+
Название металла в родительном падеже
+
Валентность-римскими цифрами
Слайд 5
Дайте названия гидроксидам
Гидроксид натрия (I)
NaOH
Fe(OH)2
Гидроксид железа (II)
Гидроксид кальция (II)
Ca(OH)2
Гидроксид алюминия(III)
Al(OH)3
Fe(OH)3
Гидроксид железа (III)
Слайд 6
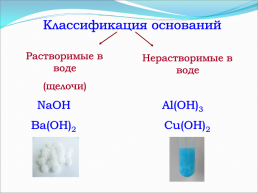
Классификация оснований
Растворимые в воде
(щелочи)
Нерастворимые в воде
NaOH
Al(OH)3
Ba(OH)2
Сu(OH)2
Слайд 7
Свойства оснований
Слайд 8
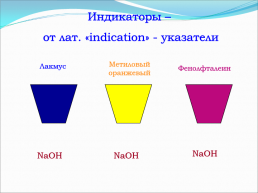
Индикаторы –
от лат. «indication» - указатели
Метиловый оранжевый
Лакмус
Фенолфталеин
NaOH
NaOH
NaOH
Слайд 9
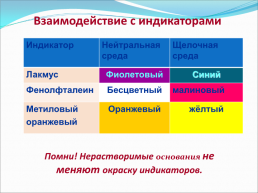
Взаимодействие с индикаторами
Индикатор.Нейтральная среда.Щелочная среда
Лакмус.Фиолетовый.Синий
Фенолфталеин.Бесцветный.малиновый
Метиловый
оранжевый.Оранжевый.жёлтый
Помни! Нерастворимые основания не меняют окраску индикаторов.
Слайд 10
Основание + кислотный оксид →
соль + вода
2KOH + N2O5 → 2KNO3 + H2O
2LiOH + SO3 → Li2SO4 + H2O
Слайд 11
Основание + кислота →соль + вода
(нейтрализация)
Растворимые основания:
NaOH + HCl →NaCl + H2O
Нерастворимые основания
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Слайд 12
Основание + соль → новое основание
+ новая соль
3NaOH+FeCl3→Fe(OH)3↓+ 3NaCl
Слайд 13
t
Нераств. основание →оксид металла+ вода
(разложение при нагревании)
Mg(OH)2 → MgO + H2O
2Fe(OH)3 → Fe2O3 + 3H2O
Данный тип реакции нехарактерен для растворимых оснований
Слайд 14
Домашнее задание
§ 41-42, задание 2,4
 Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Химические свойства металлов - Электрохимический ряд напряжения металлов
Химические свойства металлов - Электрохимический ряд напряжения металлов Общие химические свойства металлов
Общие химические свойства металлов Химические свойства кислот
Химические свойства кислот Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Свойства оксидов и оснований
Свойства оксидов и оснований Текстильные материалы из химических волокон - Свойства химических волокон
Текстильные материалы из химических волокон - Свойства химических волокон