Презентация - Способы получения металлов
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 88%
- Слайдов: 24
- Просмотров: 7243
- Скачиваний: 3282
- Размер: 1.96 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Способы получения металлов и их сплавов -Важнейшие месторождения металлов и их соединений в Казахстане
Способы получения металлов и их сплавов -Важнейшие месторождения металлов и их соединений в Казахстане Урок в 11 классе «Основные способы получения металлов»
Урок в 11 классе «Основные способы получения металлов» Обработка металлов - виды, способы и технологии металлообработки
Обработка металлов - виды, способы и технологии металлообработки Сущность электролиза как способа получения веществ
Сущность электролиза как способа получения веществ Адаптация – процесс приспособления к изменяющимся условиям внешней среды
Адаптация – процесс приспособления к изменяющимся условиям внешней среды Способы пришивания пуговиц с четырьмя отверстиями
Способы пришивания пуговиц с четырьмя отверстиями Способ вычитания столбиком
Способ вычитания столбиком
Слайды и текст этой онлайн презентации
Слайд 1

Способы получения металлов
Слайд 2

Цель урока: изучить способы получения металлов.
Задачи урока: Знать/понимать: общие способы получения металлов; экологические проблемы переработки сырья. Уметь: составлять уравнения реакций, характеризующих способы получения металлов, и рассматривать их с точки зрения окислительно - восстановительных процессов; выполнять задания на основе использования медиаресурсов сети Интернет и цифровых информационных ресурсов; анализировать, сравнивать информацию; составлять схему, отражающую способы получения металлов.
Задачи урока: Знать/понимать: общие способы получения металлов; экологические проблемы переработки сырья. Уметь: составлять уравнения реакций, характеризующих способы получения металлов, и рассматривать их с точки зрения окислительно - восстановительных процессов; выполнять задания на основе использования медиаресурсов сети Интернет и цифровых информационных ресурсов; анализировать, сравнивать информацию; составлять схему, отражающую способы получения металлов.
Слайд 3

Химическая сущность получения металлов из природных соединений
Все способы получения металлов основаны на процессе: Mn+ + ne- восстановление Mo
окислитель
Все способы получения металлов основаны на процессе: Mn+ + ne- восстановление Mo
окислитель
Слайд 4

Химическая сущность получения металлов из природных соединений
Какой процесс всегда сопровождает восстановление?
кокс (аморфный углерод) угарный газ (СО) водород другой металл
окисление
Восстановитель
СO
+2
СO2
+4
Н2O
+1
М1O
+n
Какой процесс всегда сопровождает восстановление?
кокс (аморфный углерод) угарный газ (СО) водород другой металл
окисление
Восстановитель
СO
+2
СO2
+4
Н2O
+1
М1O
+n
Слайд 5

Суть процесса Аргументы «за» и «против»
FeO + H2 =Fe + H2O(Ж) + 21 кДж Получают очень чистое железо в лабораторной практике. Н2 - дорогостоящий восстановитель.
3FeO + 2Al = 3Fe + Al2O3 + 882 кДж Применяется для сварки рельсов. Al - дорогостоящий восстановитель.
2FeO + C = 2Fe + CO2 – 137 кДж Используется редко. Реакция протекает заметно при t0>15000C
FeO + CO = Fe + CO2 + 19 кДж Наиболее дешёвый, широко применяется. Экологически грязный, получаемое железо содержит много примесей.
Способы получения железа
Какому восстановителю и почему вы отдадите предпочтение? Аргументируйте свой выбор.
FeO + H2 =Fe + H2O(Ж) + 21 кДж Получают очень чистое железо в лабораторной практике. Н2 - дорогостоящий восстановитель.
3FeO + 2Al = 3Fe + Al2O3 + 882 кДж Применяется для сварки рельсов. Al - дорогостоящий восстановитель.
2FeO + C = 2Fe + CO2 – 137 кДж Используется редко. Реакция протекает заметно при t0>15000C
FeO + CO = Fe + CO2 + 19 кДж Наиболее дешёвый, широко применяется. Экологически грязный, получаемое железо содержит много примесей.
Способы получения железа
Какому восстановителю и почему вы отдадите предпочтение? Аргументируйте свой выбор.
Слайд 6

Историческая справка
В 1729 г. купцом Григорием Вяземским был основан Кирсинский железоделательный завод. Верхневятская руда содержала до 40-48% железа. В кричный горн на слой горящего древесного угля помещались чугунные чушки. Под действием высокой температуры расплавленный металл, теряя вредные примеси, стекал вниз, образуя на поду горна ком-крицу. Тяжеловесный молот мял крицу со всех сторон до однородной массы, легко поддающейся ковке. Процесс длился 12-часовую смену. Первая кровля Зимнего дворца была выложена Кирсинским железом.
В 1729 г. купцом Григорием Вяземским был основан Кирсинский железоделательный завод. Верхневятская руда содержала до 40-48% железа. В кричный горн на слой горящего древесного угля помещались чугунные чушки. Под действием высокой температуры расплавленный металл, теряя вредные примеси, стекал вниз, образуя на поду горна ком-крицу. Тяжеловесный молот мял крицу со всех сторон до однородной массы, легко поддающейся ковке. Процесс длился 12-часовую смену. Первая кровля Зимнего дворца была выложена Кирсинским железом.
Слайд 7

Способы получения металлов
Пирометаллургический – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода(II), водорода, некоторых металлов.
Если металл входит в состав сульфидной руды, то вначале проводят её обжиг: MS + O2 → MO + SO2
Пирометаллургический – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода(II), водорода, некоторых металлов.
Если металл входит в состав сульфидной руды, то вначале проводят её обжиг: MS + O2 → MO + SO2
Слайд 8

Пирометаллургические способы получения металлов Конкретные металлы Химизм процесса
Водородотермия-восстановление водородом (H2) Pb, Cu, W, Mn, Fe, Mo, Cr, Co,Ti MO + H2 →M + H2O – Q WO3 + H2→
Восстановление коксом (С) или кремнием (Si) Cu, Zn, Sr, Pd, V, Co, Ni, Bi MO + C → M + CO – Q ZnO + C →
Восстановление оксидом углерода (ΙΙ) CO Fe, ферросплавы MO + CO → M + CO2 – Q Fe2O3 + CO →
Металлотермия-восстановление более активным металлом Cr, Fe, Mn, W MO + Al → M + Al2O3 +Q Cr 2O3 + Al →
Водородотермия-восстановление водородом (H2) Pb, Cu, W, Mn, Fe, Mo, Cr, Co,Ti MO + H2 →M + H2O – Q WO3 + H2→
Восстановление коксом (С) или кремнием (Si) Cu, Zn, Sr, Pd, V, Co, Ni, Bi MO + C → M + CO – Q ZnO + C →
Восстановление оксидом углерода (ΙΙ) CO Fe, ферросплавы MO + CO → M + CO2 – Q Fe2O3 + CO →
Металлотермия-восстановление более активным металлом Cr, Fe, Mn, W MO + Al → M + Al2O3 +Q Cr 2O3 + Al →
Слайд 9
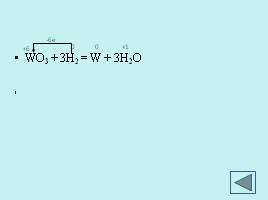
-6e-
WO3 + 3H2 = W + 3H2O ZnO + C = Zn + CO Fe2O3 + 3CO = 2Fe +3CO2 Fe + 3e-→ Fe C - 2e- → C Cr2O3 + 2Al = 2Cr + Al2O3
-6e-
-2e-
+6
-6e-
0
2
3
+2
0
+2
0
+3
+2
0
+4
0
+3
+2
+4
0
+1
+3
+3
0
0
WO3 + 3H2 = W + 3H2O ZnO + C = Zn + CO Fe2O3 + 3CO = 2Fe +3CO2 Fe + 3e-→ Fe C - 2e- → C Cr2O3 + 2Al = 2Cr + Al2O3
-6e-
-2e-
+6
-6e-
0
2
3
+2
0
+2
0
+3
+2
0
+4
0
+3
+2
+4
0
+1
+3
+3
0
0
Слайд 10

Металлотермия
Металлотермический метод впервые изучил и подробно описал русский физико–химик Н.Н. Бекетов в 1865г. В 1859г. он предложил процесс восстановления металлов из их оксидов алюминием. В настоящее время металлотермическим способом получают ферросплавы, хром, титан, уран, ниобий, цирконий, ванадий, тантал.
Николай Николаевич Бекетов (1827 - 1911)
Металлотермический метод впервые изучил и подробно описал русский физико–химик Н.Н. Бекетов в 1865г. В 1859г. он предложил процесс восстановления металлов из их оксидов алюминием. В настоящее время металлотермическим способом получают ферросплавы, хром, титан, уран, ниобий, цирконий, ванадий, тантал.
Николай Николаевич Бекетов (1827 - 1911)
Слайд 11

Алюмотермия
Слайд 12
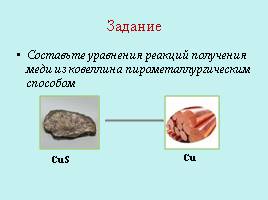
Задание
Составьте уравнения реакций получения меди из ковеллина пирометаллургическим способом
CuS
Cu
Составьте уравнения реакций получения меди из ковеллина пирометаллургическим способом
CuS
Cu
Слайд 13
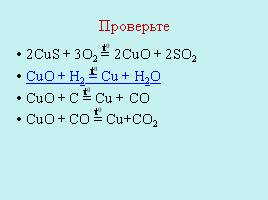
Проверьте
2CuS + 3O2 = 2CuO + 2SO2 CuO + H2 = Cu + H2O CuO + C = Cu + CO CuO + CO = Cu+CO2
t0
t0
t0
t0
2CuS + 3O2 = 2CuO + 2SO2 CuO + H2 = Cu + H2O CuO + C = Cu + CO CuO + CO = Cu+CO2
t0
t0
t0
t0
Слайд 14

Задание
К каким последствиям может привести выброс газообразных продуктов в атмосферу?
К каким последствиям может привести выброс газообразных продуктов в атмосферу?
Слайд 15

Гидрометаллургический - восстановление металлов из водных растворов их солей действием более активного металла.
1 стадия: растворение в кислоте нерастворимых минералов, содержащих металлы. 2 стадия: вытеснение металлов из растворов их солей более активными металлами.
Способы получения металлов
Данным способом получают малоактивные металлы: Cu, Ag, Zn, Cd, Mo, V
1 стадия: растворение в кислоте нерастворимых минералов, содержащих металлы. 2 стадия: вытеснение металлов из растворов их солей более активными металлами.
Способы получения металлов
Данным способом получают малоактивные металлы: Cu, Ag, Zn, Cd, Mo, V
Слайд 16

1) CuO + H2SO4 = CuSO4 + H2O
2) CuSO4 + Fe = FeSO4 + Cu
Задание. Составьте уравнения реакций получения меди из ковеллина гидрометаллургическим способом по схеме: CuO X Cu
ПРОВЕРКА
Для выполнения задания используйте Интернет – ресурс http://xn--80awbhbdcfeu.su/gidrometsposob
2) CuSO4 + Fe = FeSO4 + Cu
Задание. Составьте уравнения реакций получения меди из ковеллина гидрометаллургическим способом по схеме: CuO X Cu
ПРОВЕРКА
Для выполнения задания используйте Интернет – ресурс http://xn--80awbhbdcfeu.su/gidrometsposob
Слайд 17

Электрометаллургический – восстановление металлов в процессе электролиза расплавов или растворов их соединений.
Способы получения металлов
Химизм процесса на катоде (металлы средней и малой активности): Мn+ + ne- → М0
Способы получения металлов
Химизм процесса на катоде (металлы средней и малой активности): Мn+ + ne- → М0
Слайд 18
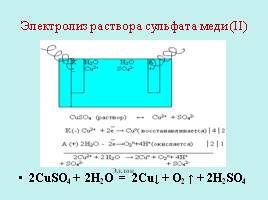
Электролиз раствора сульфата меди (ΙΙ)
2CuSO4 + 2H2O = 2Cu↓ + O2 ↑ + 2H2SO4
эл.ток
Эл.ток
2CuSO4 + 2H2O = 2Cu↓ + O2 ↑ + 2H2SO4
эл.ток
Эл.ток
Слайд 19

Микробиологический метод
Метод основан на использовании жизнедеятельности некоторых бактерий. Они растут в кислой среде и способны работать при высоких температурах. Тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод используют во всём мире как дополнительный метод выделения металлов из руд, главным образом медных и урановых.
Метод основан на использовании жизнедеятельности некоторых бактерий. Они растут в кислой среде и способны работать при высоких температурах. Тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод используют во всём мире как дополнительный метод выделения металлов из руд, главным образом медных и урановых.
Слайд 20

Преимущества
Можно использовать руды низкого качества. Требует меньших затрат. Существенно не нарушается окружающая среда, как при глубоких разработках, когда на поверхность выносят большие количества горной породы, и образуются горы отходов.
Можно использовать руды низкого качества. Требует меньших затрат. Существенно не нарушается окружающая среда, как при глубоких разработках, когда на поверхность выносят большие количества горной породы, и образуются горы отходов.
Слайд 21
Как получить из минерала металл?
?
Ковеллин CuS
Медь Cu
?
Ковеллин CuS
Медь Cu
Слайд 22

Способы получения металлов
пирометаллургический
водородотермия
восстановление углеродом, кремнием
металлотермия
восстановление оксидом углерода (ΙΙ)
электролиз растворов
электролиз расплавов
гидрометаллургический
электрометаллургический
микробиологический
Проверим
пирометаллургический
водородотермия
восстановление углеродом, кремнием
металлотермия
восстановление оксидом углерода (ΙΙ)
электролиз растворов
электролиз расплавов
гидрометаллургический
электрометаллургический
микробиологический
Проверим
Слайд 23

Выполните тест
Слайд 24

Домашнее задание
§18(с.214-216) Выполните упражнения: 1 уровень: №12 с.223-224 2 уровень: №13(6) с.224 3 уровень: Подумайте над вопросом, каким способом Нильсу Бору удалось спасти золотую медаль Нобелевского лауреата в годы второй мировой войны? Аргументируйте свой ответ с помощью уравнений химических реакций.
§18(с.214-216) Выполните упражнения: 1 уровень: №12 с.223-224 2 уровень: №13(6) с.224 3 уровень: Подумайте над вопросом, каким способом Нильсу Бору удалось спасти золотую медаль Нобелевского лауреата в годы второй мировой войны? Аргументируйте свой ответ с помощью уравнений химических реакций.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
