Презентация - Химия 10 класс «Алкины»
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 83%
- Слайдов: 20
- Просмотров: 4545
- Скачиваний: 1596
- Размер: 1.12 MB
- Класс: 10
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Алкины
Подготовила учитель химии Баузина О.В. МОУ СОШ № 25 с УИОП 11.11.2016г
Подготовила учитель химии Баузина О.В. МОУ СОШ № 25 с УИОП 11.11.2016г
Слайд 2
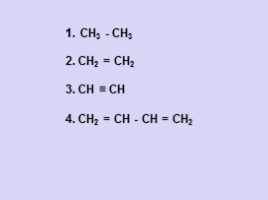
СН3 - СН3
2. СН2 = СН2
3. СН ≡ СН
4. СН2 = СН - СН = СН2
Слайд 3

1. СН3 - СН3
2. СН2 = СН2
3. СН ≡ СН
4. СН2 = СН - СН = СН2
М. Бертло
1862 г. ацетилен
Открыт в 1836 Эдмундом Дэви. Марселен Бертло в 1862 г. синтезировал из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) и дал название открытому веществу ацетилен.
М. Бертло
1862 г. ацетилен
Открыт в 1836 Эдмундом Дэви. Марселен Бертло в 1862 г. синтезировал из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) и дал название открытому веществу ацетилен.
Слайд 4

Слайд 5
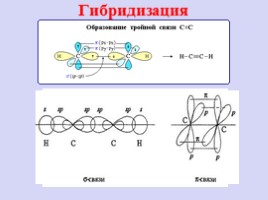
Гибридизация
Слайд 6

АЛКИНЫ
Сn H2n-2 Непредельные УВ Содержат кроме одинарных одну тройную углерод-углеродную связь. По названию первого представителя этого ряда — ацетилена — эти непредельные углеводороды называют ацетиленовыми.
Составьте гомологический ряд алкинов
Сn H2n-2 Непредельные УВ Содержат кроме одинарных одну тройную углерод-углеродную связь. По названию первого представителя этого ряда — ацетилена — эти непредельные углеводороды называют ацетиленовыми.
Составьте гомологический ряд алкинов
Слайд 7

Поиграйте в «крестики-нолики». Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
С2Н2 С10Н22 С7Н14
С6Н12 С4Н6 С5Н10
С5Н8 С4Н8 С3Н4
С2Н2 С10Н22 С7Н14
С6Н12 С4Н6 С5Н10
С5Н8 С4Н8 С3Н4
Слайд 8

Поиграйте в «крестики-нолики». Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
С2Н2 С10Н22 С7Н14
С6Н12 С4Н6 С5Н10
С5Н8 С4Н8 С3Н4
С2Н2 С10Н22 С7Н14
С6Н12 С4Н6 С5Н10
С5Н8 С4Н8 С3Н4
Слайд 9
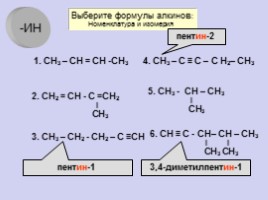
1. СН3 – СН = СН -СН3
2. СН2 = СН - С =СН2 ∣ СН3
3. СН3 – СН2 - СН2 – С ≡СН
4. СН3 – С ≡ С – С Н2– СН3
5. СН3 - СН – СН3 ∣ СН3
6. СН ≡ С - СН– СН – СН3 ∣ ∣ СН3 СН3
Выберите формулы алкинов: Номенклатура и изомерия
пентин-2
3,4-диметилпентин-1
пентин-1
-ИН
2. СН2 = СН - С =СН2 ∣ СН3
3. СН3 – СН2 - СН2 – С ≡СН
4. СН3 – С ≡ С – С Н2– СН3
5. СН3 - СН – СН3 ∣ СН3
6. СН ≡ С - СН– СН – СН3 ∣ ∣ СН3 СН3
Выберите формулы алкинов: Номенклатура и изомерия
пентин-2
3,4-диметилпентин-1
пентин-1
-ИН
Слайд 10
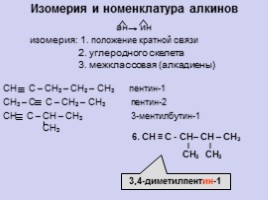
Изомерия и номенклатура алкинов
ан ин
изомерия: 1. положение кратной связи 2. углеродного скелета 3. межклассовая (алкадиены)
6. СН ≡ С - СН– СН – СН3 ∣ ∣ СН3 СН3
3,4-диметилпентин-1
изомерия: 1. положение кратной связи 2. углеродного скелета 3. межклассовая (алкадиены)
6. СН ≡ С - СН– СН – СН3 ∣ ∣ СН3 СН3
3,4-диметилпентин-1
Слайд 11

Физические свойства
Ацетилен – бесцветный газ, без запаха, мало растворим в воде, легче воздуха.
Название Формула Температура кипения
Ацетилен (этин) СH CH - 83,8
Пропин СH3 – С CH -23,3
Бутин – 1 СH3 – CH2 – С CH +8,5
Бутин – 2 СH3 – C С – CH3 +27,0
Ацетилен – бесцветный газ, без запаха, мало растворим в воде, легче воздуха.
Название Формула Температура кипения
Ацетилен (этин) СH CH - 83,8
Пропин СH3 – С CH -23,3
Бутин – 1 СH3 – CH2 – С CH +8,5
Бутин – 2 СH3 – C С – CH3 +27,0
Слайд 12

Получение
1. Метановый способ (термический крекинг , t=1500 С ) 2CH4 C2H2 +3H2 2. Карбидный способ CaC2+2H2O Ca (OH)2 + C2H2 3. Дегидрогалогенирование Br Br CH3– CH –CH–CH3 +2KOH 2KBr + 2H2O + CH3– C C – CH3 Br CH3– C – CH3 +2KOH 2KBr + 2H2O + CH3– C CH Br
1. Метановый способ (термический крекинг , t=1500 С ) 2CH4 C2H2 +3H2 2. Карбидный способ CaC2+2H2O Ca (OH)2 + C2H2 3. Дегидрогалогенирование Br Br CH3– CH –CH–CH3 +2KOH 2KBr + 2H2O + CH3– C C – CH3 Br CH3– C – CH3 +2KOH 2KBr + 2H2O + CH3– C CH Br
Слайд 13

Химические свойства
Присоединение Качественная реакция на алкины 1. Галогенирование (присоединение галогенов): Качественная реакция на пи-связь обесцвечивание бромной воды. – качественная реакция на алкины, так же как на алкены.
1 стадия. СН ≡ СН + Br2 (р-р) → СНВr = СНВr;
1,2-дибромэтен 2 стадия. СНВr = CHBr + Br2 (р-р) → СНВr2— CHBr2
1,1,2,2-тетрабромэтан Суммарное уравнение: CH ≡CH + 2Br₂→CHBr₂—CHBr₂
Окисление алкинов 1. Обесцвечивание подкисленного раствора перманганата калия – качественная реакция на соединения с кратной связью.
Присоединение Качественная реакция на алкины 1. Галогенирование (присоединение галогенов): Качественная реакция на пи-связь обесцвечивание бромной воды. – качественная реакция на алкины, так же как на алкены.
1 стадия. СН ≡ СН + Br2 (р-р) → СНВr = СНВr;
1,2-дибромэтен 2 стадия. СНВr = CHBr + Br2 (р-р) → СНВr2— CHBr2
1,1,2,2-тетрабромэтан Суммарное уравнение: CH ≡CH + 2Br₂→CHBr₂—CHBr₂
Окисление алкинов 1. Обесцвечивание подкисленного раствора перманганата калия – качественная реакция на соединения с кратной связью.
Слайд 14

1) СH CH+2H2 CH3 – CH3
2) СH CH + 2Br2 CHBr2– CHBr2
O
3) СH CH + H2OHgSO4 CH3 –C
р-ция Кучерова H
4) 3СH CH C;4000 бензол
5) СH C – CH3 + HBr СH2 = CBr–CH3
Химические свойства
Присоединение 1. Гидрирование 2. Галогенирование (Качественная реакция) 3. Гидратация (образуется ацетаналь) 4. Полимеризация (тримеризация, реакция Зелинского) 5. Гидрогалогенирование
6. Кислотные свойства алкинов
ацетиленид Ag(I).
Химические свойства
Присоединение 1. Гидрирование 2. Галогенирование (Качественная реакция) 3. Гидратация (образуется ацетаналь) 4. Полимеризация (тримеризация, реакция Зелинского) 5. Гидрогалогенирование
6. Кислотные свойства алкинов
ацетиленид Ag(I).
Слайд 15
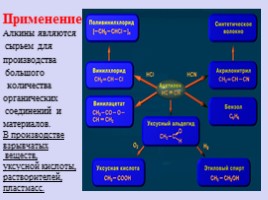
Применение
Алкины являются сырьем для производства большого количества органических соединений и материалов. В производстве взрывчатых веществ, уксусной кислоты, растворителей, пластмасс.
Алкины являются сырьем для производства большого количества органических соединений и материалов. В производстве взрывчатых веществ, уксусной кислоты, растворителей, пластмасс.
Слайд 16
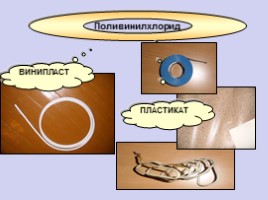
Поливинилхлорид
ПЛАСТИКАТ
ВИНИПЛАСТ
ПЛАСТИКАТ
ВИНИПЛАСТ
Слайд 17

Используют для резки и сварки металлов.
Благодаря яркому пламени в XIX веке широко распространились ацетиленовые фонари.
Благодаря яркому пламени в XIX веке широко распространились ацетиленовые фонари.
Слайд 18
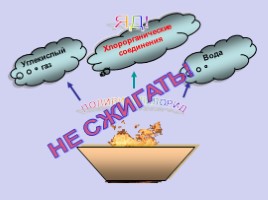
ПОЛИВИНИЛХЛОРИД
Углекислый газ
Хлорорганические соединения
Вода
ЯД!
НЕ СЖИГАТЬ!
Углекислый газ
Хлорорганические соединения
Вода
ЯД!
НЕ СЖИГАТЬ!
Слайд 19
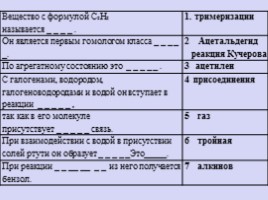
Вещество с формулой C₂H₂
называется _ _ _ _ . тримеризации
Он является первым гомологом класса _ _ _ _ _. Ацетальдегид реакция Кучерова
По агрегатному состоянию это _ _ _ _ _ . 3 ацетилен
С галогенами, водородом, галогеноводородами и водой он вступает в реакции _ _ _ _ _ , 4 присоединения
так как в его молекуле присутствует _ _ _ _ _ связь. 5 газ
При взаимодействии с водой в присутствии солей ртути он образует _ _ _ _ _Это_____. 6 тройная
При реакции _ _ __ __ _ _ из него получается бензол. 7 алкинов
Он является первым гомологом класса _ _ _ _ _. Ацетальдегид реакция Кучерова
По агрегатному состоянию это _ _ _ _ _ . 3 ацетилен
С галогенами, водородом, галогеноводородами и водой он вступает в реакции _ _ _ _ _ , 4 присоединения
так как в его молекуле присутствует _ _ _ _ _ связь. 5 газ
При взаимодействии с водой в присутствии солей ртути он образует _ _ _ _ _Это_____. 6 тройная
При реакции _ _ __ __ _ _ из него получается бензол. 7 алкинов
Слайд 20

Спасибо !
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







