Слайды и текст этой онлайн презентации
Слайд 1
Электрический ток в различных средах
Электрический ток в электролитах. Законы электролиза.
Слайд 2
Цель урока
Изучить природу тока в электролитах, закономерности, возникающие в электролитах при протекании тока, электролиз и его применение
Слайд 3
Актуализация знаний
Что такое электрический ток?
От чего зависит сила тока в проводниках?
Что является носителем тока в металлах?
Слайд 4
Электролиты
Что такое электролит?
Будут ли электролиты проводить электрический ток?
Будут ли в электролитах свободные заряженные частицы?
Слайд 5
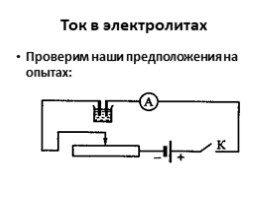
Ток в электролитах
Проверим наши предположения на опытах:
Слайд 6
Электрический ток в электролитах
Вещество Проводимость
тока
Кристаллический сахар Не проводит
Кристаллическая соль Не проводит
Дистиллированная вода Не проводит
Раствор сахара Не проводит
Раствор соли Проводит
Питьевая вода Проводит
Раствор кислоты Проводит
Слайд 7
Электрический ток в электролитах
Что является носителем тока в электролитах?
Как образуются свободные заряженные частицы в электролитах?
Что такое электролитическая диссоциация?
Слайд 8
Примеры электролитической диссоциации
Хлорид меди
CuCl2 → Cu2+ +2Cl-
Сульфат меди
CuSO4 → Cu2+ +SO42-
Слайд 9
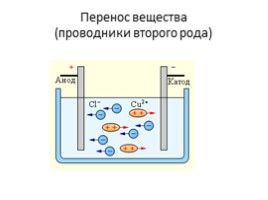
Перенос вещества (проводники второго рода)
Слайд 10
В 1833 – 34 гг. М. Фарадей установил законы электролиза
Слайд 11
Законы электролиза
1 закон:
Масса вещества, которое выделяется при прохождении электрического тока в электролитах на аноде или катоде, прямо пропорциональна заряду, который при этом переносится ионами через электролит:
m=k∙q
Слайд 12
Законы электролиза
2 закон:
Электрохимические эквиваленты веществ прямо пропорциональны массам их молей и обратно пропорциональны их валентностям
Слайд 13
Применение электролиза
Гальваностегия(позолота, никелирование, хромирование)
Гальванопластика (получение копий, печатных клише)
Рафинирование( получение чистых металлов)
Электрометаллургия (получение натрия, магния, кальция, алюминия)
Слайд 14
Задача №1
Сколько двухвалентного никеля выделяет ток 10А, за 1 ч.
Слайд 15
Задача 2
При пропускании через электролит тока 1,5 А за 5 мин на катоде выделились 137 мг вещества. Какое это вещество?
 Законы постоянного электрического тока
Законы постоянного электрического тока Электрический ток
Электрический ток Химические источники тока. Электролиз (химия)
Химические источники тока. Электролиз (химия) Работа и мощность электрического тока, тепловое действие тока
Работа и мощность электрического тока, тепловое действие тока Источники электрического тока
Источники электрического тока Химический источник электрического тока
Химический источник электрического тока Давление газа. Передача давления жидкостями и газами. Закон Паскаля
Давление газа. Передача давления жидкостями и газами. Закон Паскаля