Презентация - Окисление перманганатом и бихроматом калияорганических соединений
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 99%
- Слайдов: 108
- Просмотров: 5671
- Скачиваний: 2889
- Размер: 2.47 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Составление формул Бинарных соединений по степени окисления
Составление формул Бинарных соединений по степени окисления Соединение брусков
Соединение брусков Соединения с подшипниками качения
Соединения с подшипниками качения Соляная гора в Германии - Природные соединения щелочных металлов
Соляная гора в Германии - Природные соединения щелочных металлов Классы неорганических соединений
Классы неорганических соединений Химия 9 класс «Металлы и их соединения»
Химия 9 класс «Металлы и их соединения» Амфотерность химических соединений
Амфотерность химических соединений
Слайды и текст этой онлайн презентации
Слайд 1

Окисление перманганатом и бихроматом калияорганических соединений Уровень ЕГЭ
Слайд 2

Специфические окислители Cu O окисляет первичные и вторичные спирты спирты при нагревании. t Аммиачный раствор оксида серебра. Реакция серебряного зеркала.
Слайд 3

Специфические окислители Cu O окисляет первичные и вторичные спирты спирты при нагревании. Третичные спирты не окисляются.
Слайд 4

Взаимодействие альдегидов с гидроксидом меди. СH3-CH2-CH2-CH O Cu(OH)2 СH3-CH2-CH2-COH O Cu 2 O H2O
Слайд 5
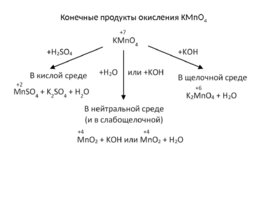
Конечные продукты окисления KMn O 4
Слайд 6

Что представляют собой «жёсткие условия»? Кислая или сильнощелочная среда даже без нагревания. Нейтральная или слабощелочная среда, но при нагревании. Что представляют собой «мягкие условия»? Нейтральная или слабощелочная среда, но без нагревания (0-20 0 С).
Слайд 7
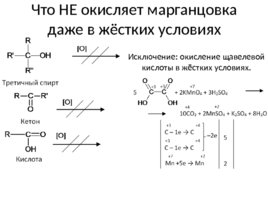
Что НЕ окисляет марганцовка даже в жёстких условиях Исключение: окисление щавелевой кислоты в жёстких условиях.
Слайд 8
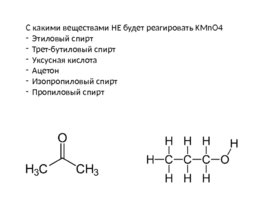
С какими веществами НЕ будет реагировать KMn O4 Этиловый спирт Трет-бутиловый спирт Уксусная кислота Ацетон Изопропиловый спирт Пропиловый спирт
Слайд 9
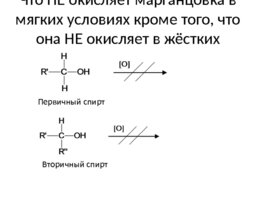
Что НЕ окисляет марганцовка в мягких условиях кроме того, что она НЕ окисляет в жёстких условиях Первичный спирт Вторичный спирт
Слайд 10
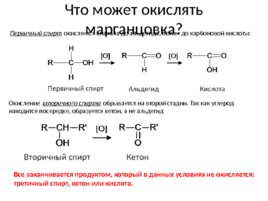
Что может окислять марганцовка? Первичный спирт окисляется сначала до альдегида, потом до карбоновой кислоты: Окисление вторичного спирта обрывается на второй стадии. Так как углерод находится посередке, образуется кетон, а не альдегид Все заканчивается продуктом, который в данных условиях не окисляется: третичный спирт, кетон или кислота.
Слайд 11

Как окисляет марганцовка двойные и тройные связи в углеводородах в мягких условиях Двойные связи до двухатомных спиртов. Тройные связи до: Кетонов, если тройная связь не с краю. Карбоновых кислот, если тройная связь с краю.
Слайд 12
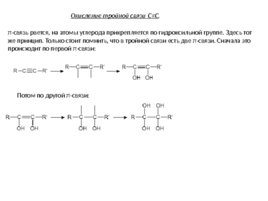
Окисление тройной связи C C . π-связь рвется, на атомы углерода прикрепляется по гидроксильной группе. Здесь тот же принцип. Только стоит помнить, что в тройной связи есть две π-связи. Сначала это происходит по первой π-связи: Потом по другой π-связи:
Слайд 13
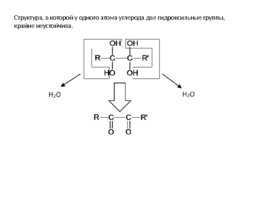
Структура, в которой у одного атома углерода две гидроксильные группы, крайне неустойчива.
Слайд 14

СH3-CH CH2 O Тренировка. Как происходит окисление марганцовкой в мягких условиях CH2 CH-CH2-CH3 CH3-CH CH-CH3
Слайд 15

Как окисляет марганцовка двойные и тройные связи в углеводородах в жёстких условиях Этилен и ацетилен до углекислого газа и воды СH2 CH2 CO2 H2O O Дизамещённые алкины и алкены дают смесь карбоновых кислот. СH2 CH-R CO2 H2O R-COOH O
Слайд 16
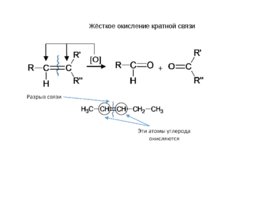
Жёсткое окисление кратной связи
Слайд 17
Слайд 18
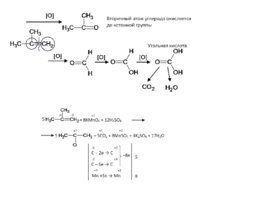
Слайд 19
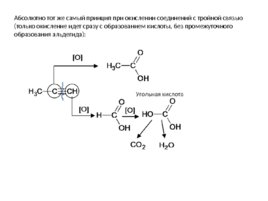
Абсолютно тот же самый принцип при окислении соединений с тройной связью (только окисление идет сразу с образованием кислоты, без промежуточного образования альдегида):
Слайд 20

Слайд 21

Закрепим на практике теорию Вернёмся к мягкому окислению.
Слайд 22
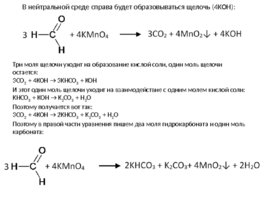
В нейтральной среде справа будет образовываться щелочь (4KOH): Три моля щелочи уходит на образование кислой соли, один моль щелочи остается: 3CO 2 4KOH 3KHCO 3 KOH И этот один моль щелочи уходит на взаимодействие с одним молем кислой соли: KHCO 3 KOH K 2 CO 3 H 2 O Поэтому получается вот так: 3CO 2 4KOH 2KHCO 3 K 2 CO 3 H 2 O Поэтому в правой части уравнения пишем два моля гидрокарбоната и один моль карбоната:
Слайд 23
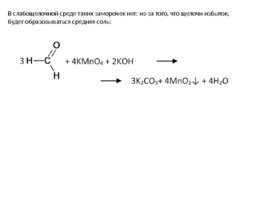
В слабощелочной среде таких заморочек нет: из-за того, что щелочи избыток, будет образовываться средняя соль:
Слайд 24
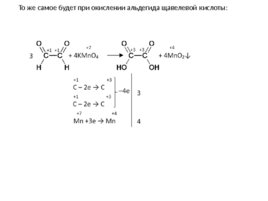
То же самое будет при окислении альдегида щавелевой кислоты:
Слайд 25
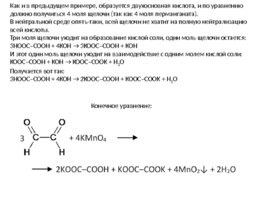
Как и в предыдущем примере, образуется двухосновная кислота, и по уравнению должно получиться 4 моля щелочи (так как 4 моля перманганата). В нейтральной среде опять-таки, всей щелочи не хватит на полную нейтрализацию всей кислоты. Три моля щелочи уходит на образование кислой соли, один моль щелочи остается: 3HOOC–COOH 4KOH 3KOOC–COOH KOH И этот один моль щелочи уходит на взаимодействие с одним молем кислой соли: KOOC–COOH KOH KOOC–COOK H 2 O Получается вот так: 3HOOC–COOH 4KOH 2KOOC–COOH KOOC–COOK H 2 O Конечное уравнение:
Слайд 26

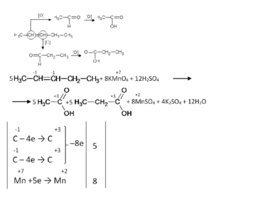
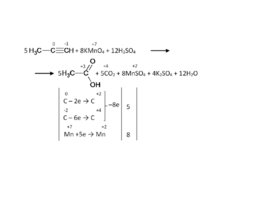
Окисление алкенов (кислая среда) В результате разрыва двойной связи образуются кетоны, карбоновые кислоты или диоксид углерода. CH 3 –CH CH–CH 3 KMn O 4 H 2 SO 4 СН 3 СООН Mn SO 4 K 2 SO 4 H 2 O C 4 H 8 4H 2 O – 8е 2С 2 Н 4 О 2 8Н 5 Mn O 4 - 8Н 5е Mn 2 4H 2 O 8 5C 4 H 8 20H 2 O 8Mn O 4 - 64Н 10С 2 Н 4 О 2 40Н 8Mn 2 32H 2 O 5CH 3 –CH CH–CH 3 8KMn O 4 12H 2 SO 4 10СН 3 СООН 8Mn SO 4 4K 2 SO 4 12H 2 O
Слайд 27

Окисление алкенов (кислая среда) В результате разрыва двойной связи образуются кетоны, карбоновые кислоты или диоксид углерода. CH 3 –CH CH 2 K 2 Cr 2 O 7 H 2 SO 4 СН 3 СООН CO 2 Cr 2 (SO 4 ) 3 K 2 SO 4 H 2 O C 3 H 6 4H 2 O – 10е С 2 Н 4 О 2 CO 2 10Н 3 Cr 2 O 7 2- 14Н 6е 2Cr 3 7H 2 O 5 3C 3 H 6 12H 2 O 5Cr 2 O 7 2- 70Н 3С 2 Н 4 О 3CO 2 30Н 10Cr 3 35H 2 O 3CH 3 –CH CH 2 5K 2 Cr 2 O 7 20H 2 SO 4 3 СН 3 СООН 3 CO 2 5Cr 2 (SO 4 ) 3 5K 2 SO 4 23H 2 O 4 32 -2 -1
Слайд 28

Окисление алкенов (кислая среда) В результате разрыва двойной связи образуются кетоны , карбоновые кислоты или диоксид углерода. KMn O 4 H 2 SO 4 CH 3 COOH Mn SO 4 K 2 SO 4 H 2 O C 5 H 10 3H 2 O – 6е С 3 Н 6 О С 2 Н 4 О 2 6Н 5 Mn O 4 - 8Н 5е Mn 2 4H 2 O 6 5C 5 H 10 15H 2 O 6Mn O 4 - 48Н 5С 3 Н 6 О 5C 2 H 4 O 2 30Н 6Mn 2 24H 2 O 5 6KMn O 4 9H 2 SO 4 5СН 3 СООН 5 6Mn SO 4 3K 2 SO 4 9H 2 O
Слайд 29
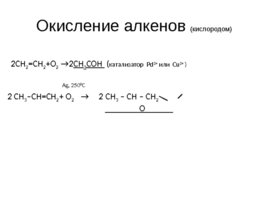
Окисление алкенов (кислородом) 2CH 2 CH 2 O 2 2 СН 3 СОН ( катализатор Pd 2 или Cu 2 ) Ag, 250 0 C 2 CH 3 –CH CH 2 O 2 2 CH 3 – CH – CH 2 O
Слайд 30

Окисление алкинов (кислая среда) CH 3 –C C–СН 2 –CH 3 KMn O 4 H 2 SO 4 СН 3 СООН С 2 Н 5 СООН Mn SO 4 K 2 SO 4 H 2 O C 5 H 8 4H 2 O – 6е С 2 Н 4 О 2 С 3 Н 6 О 2 6Н 5 Mn O 4 - 8Н 5е Mn 2 4H 2 O 6 5C 5 H 8 20H 2 O 6Mn O 4 - 48Н 5С 2 Н 4 О 2 5С 3 Н 6 О 2 30Н 6Mn 2 24H 2 O 5CH 3 –C C–СН 2 –CH 3 6KMn O 4 9H 2 SO 4 5СН 3 СООН 5С 2 Н 5 СООН 6Mn SO 4 3K 2 SO 4 4H 2 O
Слайд 31
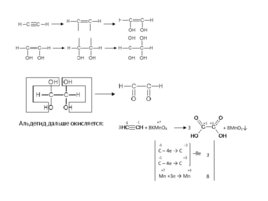
Альдегид дальше окисляется:
Слайд 32
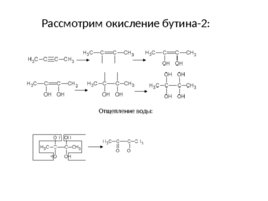
Рассмотрим окисление бутина-2: Отщепление воды:
Слайд 33
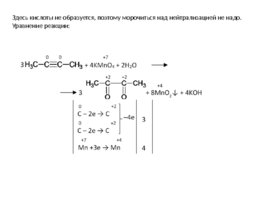
Здесь кислоты не образуется, поэтому морочиться над нейтрализацией не надо. Уравнение реакции:
Слайд 34

Вывод: окисление алкенов в нейтральный и слабощелочных условиях перманганатом Углерод с тройной связью окисляется: До кетонной группы, если этот углерод не с краю (где-то в середине цепи) До карбоксильной группы, если с краю (но затем кислота нейтрализуется образовавшейся щелочью – получается соль)
Слайд 35

Задача. Как окислится пропин в кислой среде перманганатом калия?
Слайд 36
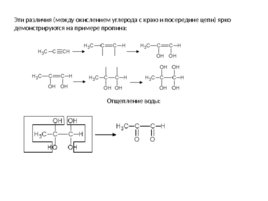
Эти различия (между окислением углерода с краю и посередине цепи) ярко демонстрируются на примере пропина: Отщепление воды:
Слайд 37
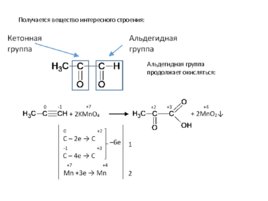
Получается вещество интересного строения: Альдегидная группа продолжает окисляться:
Слайд 38
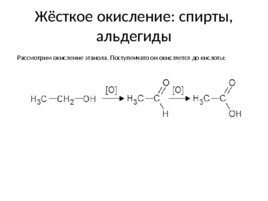
Жёсткое окисление: спирты, альдегиды Рассмотрим окисление этанола. Поступенчато он окисляется до кислоты:
Слайд 39

Слайд 40

Если реакцию проводить при температуре кипения альдегида, когда он будет образовываться, то будет испаряться (улетать) из реакционной смеси, не успевая окисляться дальше. Того же эффекта можно добиться в очень щадящих условиях (слабое нагревание). В этом случае в качестве продукта пишем альдегид:
Слайд 41

Рассмотрим окисление вторичного спирта на примере пропанола-2. Как уже было сказано, окисление обрывается на втором этапе (образование карбонильного соединения). Так как образуется кетон, который не окисляется. Уравнение реакции:
Слайд 42
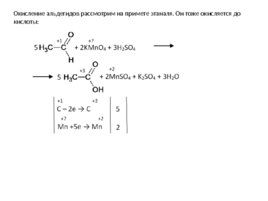
Окисление альдегидов рассмотрим на примете этаналя. Он тоже окисляется до кислоты:
Слайд 43

Слайд 44
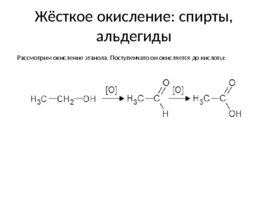
Жёсткое окисление: спирты, альдегиды Рассмотрим окисление этанола. Поступенчато он окисляется до кислоты:
Слайд 45

Слайд 46

Если реакцию проводить при температуре кипения альдегида, когда он будет образовываться, то будет испаряться (улетать) из реакционной смеси, не успевая окисляться дальше. Того же эффекта можно добиться в очень щадящих условиях (слабое нагревание). В этом случае в качестве продукта пишем альдегид:
Слайд 47

Рассмотрим окисление вторичного спирта на примере пропанола-2. Как уже было сказано, окисление обрывается на втором этапе (образование карбонильного соединения). Так как образуется кетон, который не окисляется. Уравнение реакции:
Слайд 48
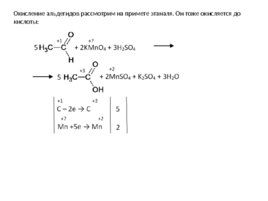
Окисление альдегидов рассмотрим на примете этаналя. Он тоже окисляется до кислоты:
Слайд 49

Слайд 50
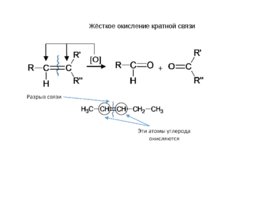
Жёсткое окисление кратной связи
Слайд 51

Слайд 52
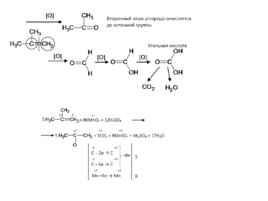
Слайд 53
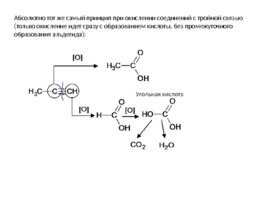
Абсолютно тот же самый принцип при окислении соединений с тройной связью (только окисление идет сразу с образованием кислоты, без промежуточного образования альдегида):
Слайд 54
Слайд 55
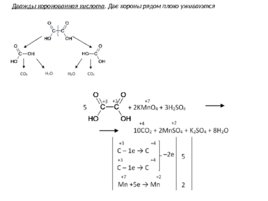
Дважды коронованная кислота . Две короны рядом плохо уживаются
Слайд 56
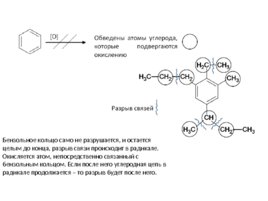
Бензольное кольцо само не разрушается, и остается целым до конца, разрыв связи происходит в радикале. Окисляется атом, непосредственно связанный с бензольным кольцом. Если после него углеродная цепь в радикале продолжается – то разрыв будет после него.
Слайд 57
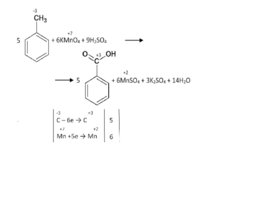
Слайд 58
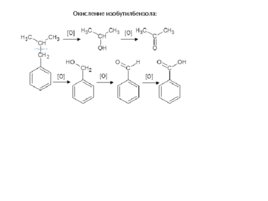
Окисление изобутилбензола:
Слайд 59
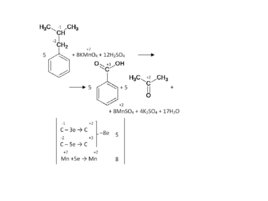
Слайд 60
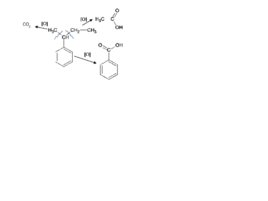
Слайд 61
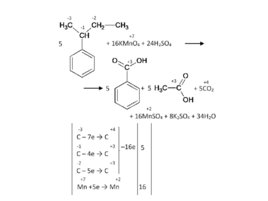
Слайд 62
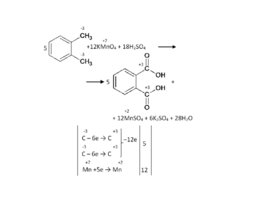
Слайд 63
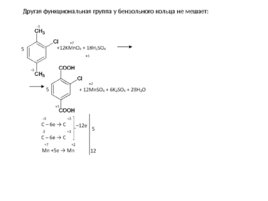
Другая функциональная группа у бензольного кольца не мешает:
Слайд 64
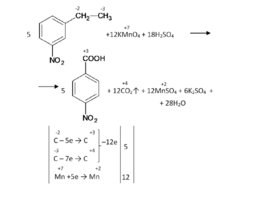
Слайд 65

Алгоритм «как записать реакцию жесткого окисления перманганатом в кислой среде»: 1. Записать исходные вещества (органика KMn O 4 H 2 SO 4 ). 2. Записать продукты окисления органики (окисляться будут соединения содержащие спиртовую, альдегидную группы, кратные связи, а также гомологи бензола). 3. Записать продукт восстановления перманганата (Mn SO 4 K 2 SO 4 H 2 O). 4. Определить степени окисления у участников ОВР. Составить баланс. 5. Проставить коэффициенты у окислителя и восстановителя, а также у веществ, которые из них образуются. 6. Затем рекомендовано посчитать сколько сульфат-анионов в правой части уравнения, в соответствии с этим поставить коэффициент перед серной кислотой слева. 7. В конце поставить коэффициент перед водой.
Слайд 66

Окислительно-восстановительные реакции с участием дихромата (бихромата) калия. Бихромат не имеет такого большого разнообразия реакций окисления органики в ЕГЭ. Окисление бихроматом проводится как правило только в кислой среде. При это хром восстанавливается до 3. Продукты восстановления: Окисление будет жестким. Реакция будет очень похожа на окисление перманганатом. Окисляться будут те же вещества, что окисляются перманганатом в кислой среде, образовываться будут те же продукты.
Слайд 67

Если проводить окисление спирта при температуре кипения альдегида, то он будет уходить их реакционной смеси, не подвергаясь окислению: В противном случае, спирт может быть напрямую окислен до кислоты.
Слайд 68

Альдегид, полученный в ходе предыдущей реакции, можно «поймать», и заставить его окисляться до кислоты:
Слайд 69
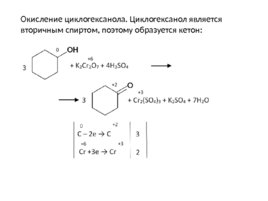
Окисление циклогексанола. Циклогексанол является вторичным спиртом, поэтому образуется кетон:
Слайд 70
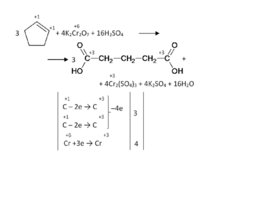
Слайд 71

Некоторые неадекватности в в ЕГЭ. Приведённые правила касательно ЖЁСТКОГО окисления гомологов бензола при условии наличия в радикалах окисляемых групп в ЕГЭ не соответствуют действительности, но их нужно применять.
Слайд 72
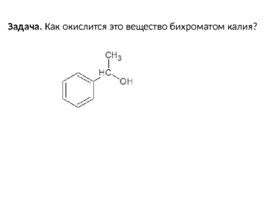
Задача. Как окислится это вещество бихроматом калия?
Слайд 73
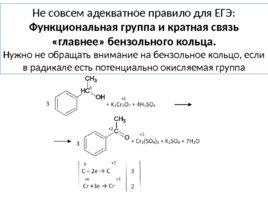
Не совсем адекватное правило для ЕГЭ: Функциональная группа и кратная связь «главнее» бензольного кольца. Нужно не обращать внимание на бензольное кольцо, если в радикале есть потенциально окисляемая группа
Слайд 74
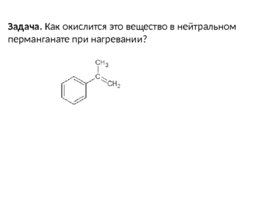
Задача. Как окислится это вещество в нейтральном перманганате при нагревании?
Слайд 75
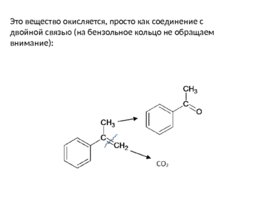
Это вещество окисляется, просто как соединение с двойной связью (на бензольное кольцо не обращаем внимание):
Слайд 76
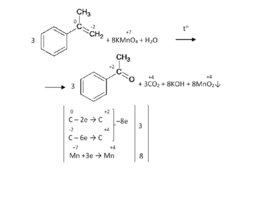
Слайд 77
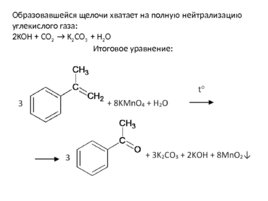
Образовавшейся щелочи хватает на полную нейтрализацию углекислого газа: 2KOH CO 2 K 2 CO 3 H 2 O Итоговое уравнение:
Слайд 78
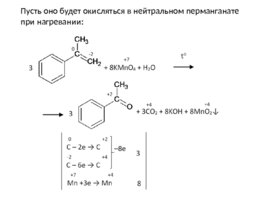
Пусть оно будет окисляться в нейтральном перманганате при нагревании:
Слайд 79
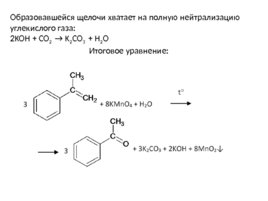
Образовавшейся щелочи хватает на полную нейтрализацию углекислого газа: 2KOH CO 2 K 2 CO 3 H 2 O Итоговое уравнение:
Слайд 80

Задача. Как окислится это вещество перманганатом калия в кислой среде?
Слайд 81
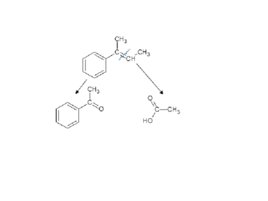
Слайд 82
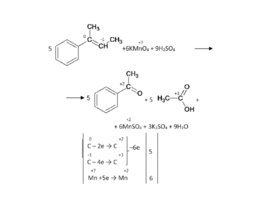
Слайд 83

Задача. Как окислится это вещество перманганатом калия в сильно щелочных условиях?
Слайд 84
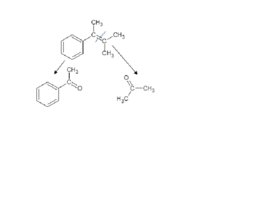
Слайд 85
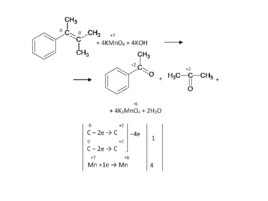
Слайд 86
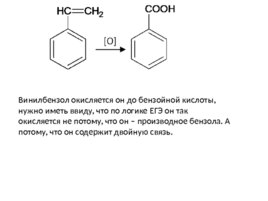
Винилбензол окисляется он до бензойной кислоты, нужно иметь ввиду, что по логике ЕГЭ он так окисляется не потому, что он – производное бензола. А потому, что он содержит двойную связь.
Слайд 87

Второе несоответствие ЕГЭ реальности При избытке окислителей в любой среде первичные спирты превращаются в карбоновые кислоты или соли карбоновых кислот, вторичные спирты превращаются в кетоны. В ЕГЭ об этом нужно забыть.
Слайд 88

Ещё одно отличие от ЕГЭ: третичные спирты окисляютя, но в кислотных (а не щелочных) условиях. Процесс идёт через стадию дегидратации спирта с последующим жёстким окислением алкена. Дегидратация спиртов протекает в кислых условиях через протонирование гидроксидной группы с последующим отщеплением воды с образованием карбониевого катиона, который в случае третичных спиртов наиболее стабилен.
Слайд 89

Ещё одно отличие от ЕГЭ: На сам
Слайд 90

СH3-CH2-OH Cu O CH3-CH O Cu H2O t
Слайд 91

Слайд 92

Слайд 93

Слайд 94

Слайд 95

Слайд 96

Слайд 97

Слайд 98

Слайд 99

Слайд 100

Слайд 101

Слайд 102

Слайд 103

Слайд 104

Слайд 105

Слайд 106

Слайд 107

Слайд 108

^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
