Слайды и текст этой онлайн презентации
Слайд 2
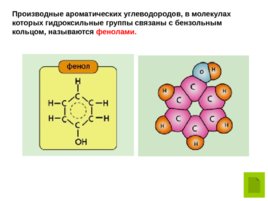
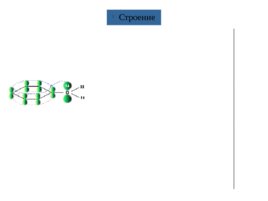
Производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с бензольным кольцом, называются фенолами.
Слайд 3
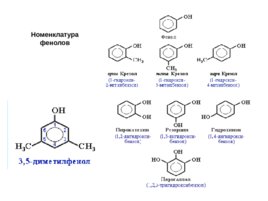
Номенклатура фенолов
Слайд 5
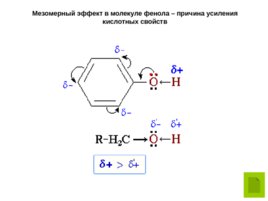
Мезомерный эффект в молекуле фенола – причина усиления кислотных свойств
Слайд 6
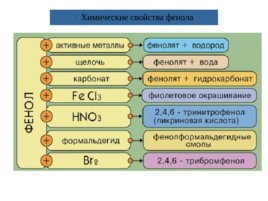
Химические свойства фенола
Слайд 7
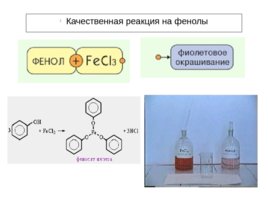
Фенолы – более сильные кислоты, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с -электронной системой бензольного кольца полярность связи О–Н увеличивается. Фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты : C 6 H 5 OH Na OH C 6 H 5 ONa H 2 O фенолят натрия Образование фенолята железа под действием раствора хлорида железа (III) является качественной реакцией на фенолы (раствор приобретает коричнево-фиолетовую окраску).
Слайд 8
Качественная реакция на фенолы
Слайд 9
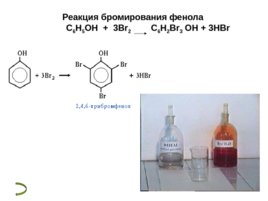
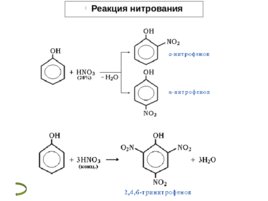
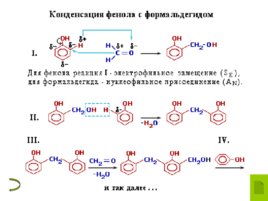
Реакции фенола по бензольному кольцу Гидроксильная группа фенола повышает электронную плотность в бензольном кольце, особенно, в орто - и пара -положениях ( М -эффект ОН-группы). Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения ( S E ) в ароматическом кольце. 1. Нитрование . Под действием 20% азотной кислоты HNO 3 фенол легко превращается в смесь орто - и пара -нитрофенолов . При использовании концентрированной HNO 3 образуется 2,4,6- тринитрофенол (пикриновая кислота) 2. Галогенирование . Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол) 3. Конденсация с альдегидами . Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол. Получение
Слайд 10
Реакция бромирования фенола С 6 Н 5 OH 3Br 2 C 6 H 2 Br 3 OH 3HBr
Слайд 11
Реакция нитрования
Слайд 13
Получение 1- Получают фенол по схеме: C 6 H 6 C 6 H 5 Cl C 6 H 5 OH 2- кумольный способ (из изопропилбензола)
Слайд 14
- производство фенолформальдегидных смол; - полупродукт в органическом синтезе производство красителей производство лекарств (резорцин) в составе фотоматериалов (гидрохинон) в составе антиоксидантов Применение
Слайд 15
Вопросы для контроля: 1. Какие вещества относят к фенолам? 2. Почему фенол проявляет кислотные свойства сильнее, чем одноатомные спирты? 3. Какие химические свойства характерны для фенола? 4. Какие реакции можно использовать для идентификации фенола? 5. Как получают фенол? 6. Назовите области применения фенола и его производных.
 Использование дневника фенологических наблюдений на уроках биологии в 6 классе, как элемента регионального Кубанского компонента содержания общего образования.
Использование дневника фенологических наблюдений на уроках биологии в 6 классе, как элемента регионального Кубанского компонента содержания общего образования.
 Быт донских казаков
Быт донских казаков
 Экология человека
Экология человека
 Волшебный квиллинг
Волшебный квиллинг
 Проект по математике: «ЧИСЛА ВОКРУГ НАС
Проект по математике: «ЧИСЛА ВОКРУГ НАС
 The second of October Tuesday
The second of October Tuesday
 Жизнь и творчество Василия Макаровича Шукшина
Жизнь и творчество Василия Макаровича Шукшина