Слайды и текст этой онлайн презентации
Слайд 2
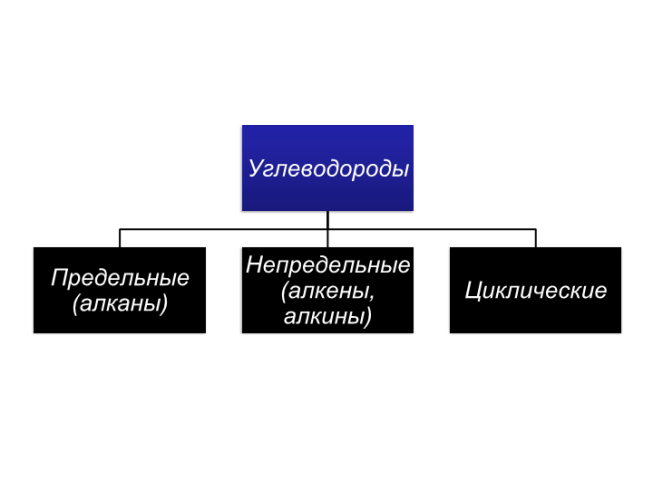
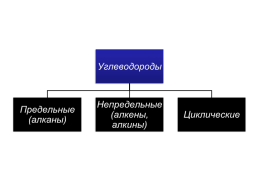
Предельные углеводороды. (Алканы)
Слайд 3
Простейшим представителем алканов является:
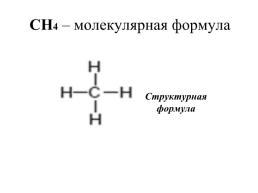
метан - СН4
Слайд 4
СН4 – молекулярная формула
Структурная формула
Слайд 5
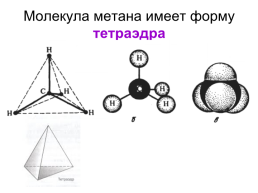
Молекула метана имеет форму тетраэдра
Слайд 6
Общая формула алканов:
СnH2n+2
где n – количество атомов углерода.
Слайд 8
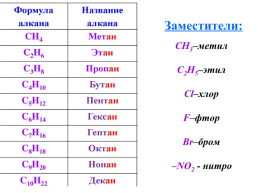
Названия заместителей
СН3–метил
С2Н5–этил
Сl–хлор
F–фтор
Br–бром
–NO2 - нитро
Слайд 9
Заместители:
СН3–метил
С2Н5–этил
Сl–хлор
F–фтор
Br–бром
–NO2 - нитро
Слайд 12
а) путем гидрирования – прибавление водорода.
C2H4 + H2= C2H6
Слайд 13
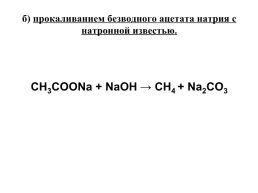
б) прокаливанием безводного ацетата натрия с натронной известью.
CH3COONa + NaOH → CH4 + Na2CO3
Слайд 14
1) Реакции замещения А) Реакции галогенирования
СН4 + Cl2 → CH3Cl + HCl (на свету)
CH4 + Br2 → CH3Br + HBr.
Слайд 15
Б) Реакция нитрования по Коновалову (с раствором азотной кислоты при 120ºС).
СН4 + НNO3 → СН3NO2 + Н2О
Слайд 16
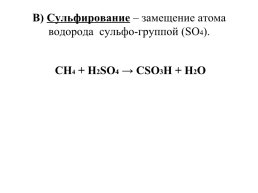
В) Сульфирование – замещение атома водорода сульфо-группой (SO4).
СН4 + Н2SO4 → СSO3H + Н2О
Слайд 17
2) Реакции отщепления А) Дегидрирование – отщепление водорода при нагревании
СН4 → СН2 + Н2
Слайд 18
Б) Крекинг алканов – нагревание при температуре 400-500 ºС
С4Н10 → С2Н4 + С2Н6
Слайд 19
В) Термическое разложение - нагрев до 1000ºС
СН4 → С + 2Н2
Слайд 20
Г) Пиролиз метана – нагрев до 1500 ºС
2СН4 → С2Н2 + 3Н2
Слайд 21
3) Реакции окисления Горение
CH4 + 2O2 → CO2 + 2 H2O
2С6Н14+19O2=12CO2+14H2O
Слайд 22
Применение алканов
 Предельные углеводороды
Предельные углеводороды Викторина «Непредельные углеводороды»
Викторина «Непредельные углеводороды» Непредельные углеводороды. (Алкены)
Непредельные углеводороды. (Алкены) Непредельные углеводороды. (Алкины)
Непредельные углеводороды. (Алкины) Контрольная работа № 1 по теме. «Предельные углеводороды»
Контрольная работа № 1 по теме. «Предельные углеводороды» Строение ароматических углеводородов - Ароматическая связь
Строение ароматических углеводородов - Ароматическая связь Нефть - ценный источник углеводородов или экологическая проблема
Нефть - ценный источник углеводородов или экологическая проблема