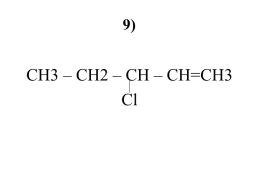Слайды и текст этой онлайн презентации
Слайд 1
Непредельные углеводороды. (Алкены)
Слайд 2
Простейшим представителем алкенов является:
Этен (этилен) – С2Н4
Слайд 3
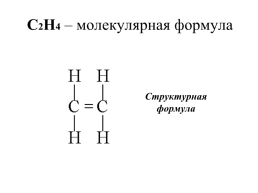
С2Н4 – молекулярная формула
Структурная формула
Слайд 4
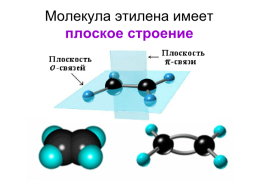
Молекула этилена имеет плоское строение
Слайд 5
Общая формула алкенов:
СnH2n
где n – количество атомов углерода.
Слайд 6
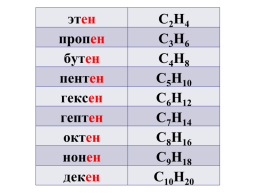
этен.C2H4
пропен.C3H6
бутен.C4H8
пентен.C5H10
гексен.C6H12
гептен.C7H14
октен.C8H16
нонен.С9Н18
декен.С10Н20
Слайд 7
Названия заместителей
СН3–метил
С2Н5–этил
Сl–хлор
F–фтор
Br–бром
NO2 - нитро
Слайд 8
этен.C2H4
пропен.C3H6
бутен.C4H8
пентен.C5H10
гексен.C6H12
гептен.C7H14
октен.C8H16
нонен.С9Н18
декен.С10Н20
Заместители:
СН3–метил
С2Н5–этил
Сl–хлор
F–фтор
Br–бром
NO2 - нитро
Слайд 16
9)
СН3 – СН2 – СН – СН=СН3
Сl
Слайд 17
1)
4 – метилгептен-1
Слайд 18
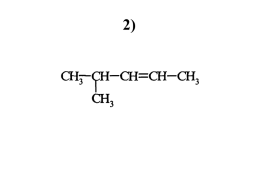
2)
2 – хлор, 3 - бромпентен-1
Слайд 19
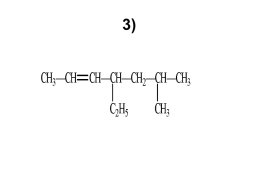
3)
1– нитробутен-2
Слайд 20
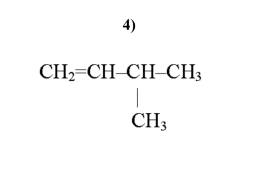
4)
4,5 - диметилгексен-1
Слайд 21
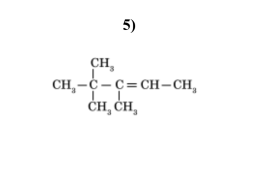
5)
3 – этилгептен-2
Слайд 22
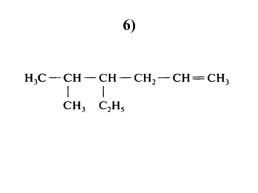
6)
2,3,4,5 – тетраметилгексен-3
Слайд 23
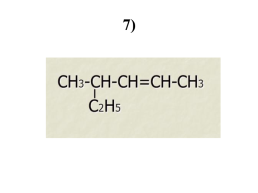
7)
4 – метилпентен-2
Слайд 24
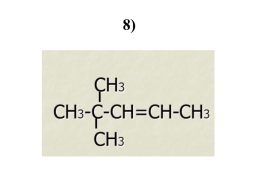
8)
2,3 – дихлоргексен-5
Слайд 25
Физические свойства
C19H38 и т.д. – твердые вещества.
С C5 H10 до C18H36 - жидкости
C С2H4 до C4H8 - газы
Слайд 26
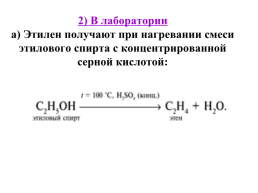
2) В лаборатории а) Этилен получают при нагревании смеси этилового спирта с концентрированной серной кислотой:
Слайд 27
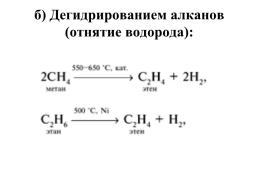
б) Дегидрированием алканов (отнятие водорода):
Слайд 28
в) Из галогенопроизводных алканов:
Слайд 29
1) Реакции присоединения. а) Присоединение водорода (гидрирование):
Слайд 30
б) Присоединение галогенов (лабораторный опыт по обесцвечиванию бромной воды):
Слайд 31
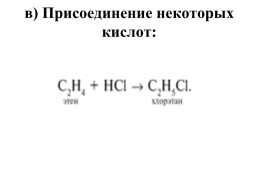
в) Присоединение некоторых кислот:
Слайд 32
г) Присоединение воды (реакция гидратации):
Слайд 33
2) Реакции окисления. а) Горение
Слайд 34
б) Окисление этилена перманганатом калия:
3СH2 = СН2 + 2KMnO4 + 4H2O →
3СH2(ОН) – СН2(ОН) + 2MnO2 + 2KOH
Слайд 35
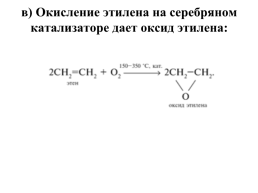
в) Окисление этилена на серебряном катализаторе дает оксид этилена:
Слайд 36
3) Реакция полимеризации.
Слайд 38
Натуральный каучук
 Викторина «Непредельные углеводороды»
Викторина «Непредельные углеводороды» Непредельные углеводороды. (Алкины)
Непредельные углеводороды. (Алкины) Строение ароматических углеводородов - Ароматическая связь
Строение ароматических углеводородов - Ароматическая связь Нефть - ценный источник углеводородов или экологическая проблема
Нефть - ценный источник углеводородов или экологическая проблема Классификация углеводородов
Классификация углеводородов Природные источники углеводородов
Природные источники углеводородов Природные углеводороды - Нефть
Природные углеводороды - Нефть