Слайды и текст этой онлайн презентации
Слайд 2
Демонстрационный эксперимент.
Слайд 3
Демонстрационный эксперимент.
Zn + H2SO4 → ZnSO4 + H2↑
K2Cr2O7 + 3H2 + 4H2SO4 → K2SO4 + Cr2(SO4)3 +7H2O
Cr2(SO4)3 + H2 → 2CrSO4 + H2SO4
4CrSO4 + O2 + 2H2SO4 → 2Cr2(SO4)3 +2H2O
Слайд 4
Окислительно-восстановительные реакции.
Слайд 5
Вопросы:
Что называется степенью окисления?
Что такое окислитель?
Что такое восстановитель?
Какой процесс называется восстановлением?
Какой процесс называется окислением?
Какие вещества могут быть только окислителями? Приведите примеры.
Какие вещества могут быть только восстановителями? Приведите примеры.
Какие вещества могут быть и окислителями, и восстановителями? Приведите примеры.
Какой метод составления уравнения окислительно-восстановительных реакций вы знаете?
Слайд 6
Окислитель.Восстановитель
+ ē.- ē
↓ С.О..↑ С.О.
Восстановился.Окислился
Процесс восстановления.Процесс окисления
# простые вещества -неметаллы (O2, Cl2,Br2…);
# соединения, содержащие элемент в высшей степени окисления (KMnO4, K2Cr2O7, H2SO4, HNO3…).# простые вещества -металлы (Na, K, Ca…);
# соединения, содержащие элемент в низшей степени окисления (NH3, H2S, CuCl, FeCl2…)
Слайд 8
Лабораторный опыт. Используя методичку, проделайте химический опыт. Запишите соответствующее уравнение химической реакции. Уравняйте методом электронного баланса.
Слайд 9
Проверяем результаты:
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Na2SO3 + 2KMnO4 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
5Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
3Na2SO3 + K2Cr2O7 + 4H2SO4 → 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
3Na2SO3 + K2Cr2O7 + 4KOH + 4H2O → 3Na2SO4 + 2K3[Cr(OH)6]
Слайд 10
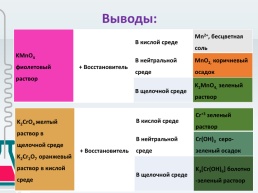
Выводы:
KMnO4
фиолетовый раствор.+ Восстановитель.В кислой среде.Mn2+, бесцветная соль
В нейтральной среде.MnO2, коричневый осадок
В щелочной среде.K2MnO4, зеленый раствор
K2CrO4 желтый раствор в щелочной среде
K2Cr2O7 оранжевый раствор в кислой среде.+ Восстановитель.В кислой среде.Cr+3 зеленый раствор
В нейтральной среде.Cr(OH)3 серо-зеленый осадок
В щелочной среде.K3[Cr(OH)6] болотно-зеленый раствор
Слайд 11
Закрепление.
Задание 30.
Допустимо использование водных растворов веществ. Из предложенного перечня выберете вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение окислительно-восстановительной реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения заданий используйте следующий перечень веществ: перманганат калия, йодид калия, фторид аммония, гидроксид цинка, сульфат магния, гидрокарбонат кальция.
Слайд 12
Задание 32.
Нитрат меди (II) прокалили, образовавшееся твёрдое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекало с выделением бурого газа. Напишите уравнения описанных реакций.
Слайд 13
Список литературы:
Глинка Н.Л. Общая химия. / М.: Химия, 1985.
Рудзитис Г.Е., Фельдман Ф.Г. Учебники по химии 8, 9, 11 классов – М.: Просвещение 2012 – 2016
http://www.mylaboratory.ru/fun/experiments/bichromatreborn
ЕГЭ. Химия: типовые экзаменационные материалы: 30 вариантов/ под ред. Д.Ю. Добротина. – М.: Издательство «Национальное образование, 2020.
 Урок обобщения и систематизации знаний по теме Тип Членистоногие. 7-й класс
Урок обобщения и систематизации знаний по теме Тип Членистоногие. 7-й класс Окислительно-восстановительные реакции или овр
Окислительно-восстановительные реакции или овр Литературное чтение 2 класс 54 урок - Обобщение по разделу «О братьях наших меньших»
Литературное чтение 2 класс 54 урок - Обобщение по разделу «О братьях наших меньших» Урок обобщения и контроля "Атмосфера" (6 класс)
Урок обобщения и контроля "Атмосфера" (6 класс) Урок русского языка 4 класс. Обобщение по теме Глагол
Урок русского языка 4 класс. Обобщение по теме Глагол Урок обобщения знаний в 11 классе «Синонимы - Антонимы - Омонимы - Паронимы»
Урок обобщения знаний в 11 классе «Синонимы - Антонимы - Омонимы - Паронимы» Урок обобщения и систематизации знаний по теме «Решение уравнений»
Урок обобщения и систематизации знаний по теме «Решение уравнений»