Презентация - Окислительные свойства концентрированной серной и азотной (концентрированной и разбавленной) кислот
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 82%
- Слайдов: 14
- Просмотров: 1141
- Скачиваний: 124
- Размер: 1.29 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

11.01.2023
Окислительные свойства концентрированной серной и азотной (концентрированной и разбавленной) кислот
Слайд 2

Серная кислота
Серная кислота - сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум - раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Химические свойства серной кислоты
1) Кислотные свойства
В водном растворе диссоциирует ступенчато.
H2SO4 ⇄ H+ + HSO4-
HSO4- ⇄ H+ + SO42-
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли - сульфаты.
MgO + H2SO4 → MgSO4 + H2O
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 - кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 - средняя соль)
Слайд 3

2. Реакции с солями
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
BaBr2 + H2SO4 → BaSO4↓ + 2HBr
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
3. Реакция с неметаллами
Серная кислота окисляет неметаллы - серу и углерод - соответственно до угольной кислоты (нестойкой) и сернистого газа.
S + H2SO4 → SO2 + H2O
C + H2SO4 → CO2 + SO2 + H2O
4. Реакции с металлами
Разбавленная серная кислота с металлами реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после - не реагируют с ней. Железо и хром окисляются до +2.
Fe + H2SO4(разб.) → FeSO4 + H2↑
Zn + H2SO4(разб.) → ZnSO4 + H2↑
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Слайд 4

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности - S, с малоактивными металлами - SO2.
Na + H2SO4(конц.) → Na2SO4 + H2S + H2O Zn + H2SO4(конц.) → ZnSO4 + S + H2O Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O
Na + H2SO4(конц.) → Na2SO4 + H2S + H2O Zn + H2SO4(конц.) → ZnSO4 + S + H2O Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O
Слайд 5
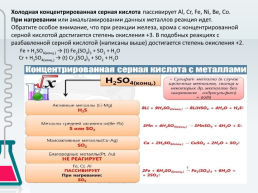
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Fe + H2SO4(конц.) → (t) Fe2(SO4)3 + SO2 + H2O
Cr + H2SO4(конц.) → (t) Cr2(SO4)3 + SO2 + H2O
Слайд 6

Слайд 7

Азотная кислота
Химические свойства
Кислотные свойства
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
2. Термическое разложение
При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
HNO3 → (hv) NO2 + H2O + O2
3. Реакции с неметаллами
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная - до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O
Слайд 8

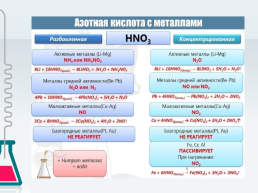
4. Реакции с металлами
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% - конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% - ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% - разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% - оч. разб.) → Zn(NO3)2 + N2 + H2O
Слайд 9
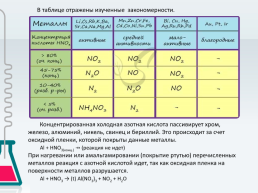
В таблице отражены изученные закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы. Al + HNO3(конц.) ⇸ (реакция не идет) При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается. Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы. Al + HNO3(конц.) ⇸ (реакция не идет) При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается. Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Слайд 10
Слайд 11

Слайд 12

Слайд 13

Ответьте на вопросы
Что такое гигроскопичность?
Почему же на моем полотенце остались эти ужасные дырки? Но ведь мы не работали вчера с концентрированной серной кислотой. Объясните о чём идёт речь.
Что такое пассивация?
Один из заводов по производству серной кислоты находиться в Саратовской области в городе Балаково, из чего необходимо изготовить ж/д цистерну, чтобы доставить концентрированную кислоту в Пензенскую область?
Что такое гигроскопичность?
Почему же на моем полотенце остались эти ужасные дырки? Но ведь мы не работали вчера с концентрированной серной кислотой. Объясните о чём идёт речь.
Что такое пассивация?
Один из заводов по производству серной кислоты находиться в Саратовской области в городе Балаково, из чего необходимо изготовить ж/д цистерну, чтобы доставить концентрированную кислоту в Пензенскую область?
Слайд 14

Выполните тест
1. Степень окисления азота в азотной кислоте равна: А) +5; Б) +4; В) -3.
А
2. При взаимодействии с какими веществами азотная кислота проявляет особые свойства, отличающие её от других кислот: А) основными оксидами; Б) металлами; В) основаниями.
Б
3. В окислительно-восстановительной реакции азотная кислота может участвовать в качестве: А) окислителя; Б) восстановителя; В) окислителя и восстановителя.
А
4. Какое из данных соединений азота называют чилийской селитрой: А) нитрат калия; Б) нитрат кальция; В) нитрат натрия;
В
5. Запишите уравнение взаимодействия меди с концентрированной азотной кислотой . Коэффициент перед формулой кислоты равен: А) 2; Б) 4; В) 1.
Б
6. Какое из перечисленных веществ не реагирует с разбавленной азотной кислотой: А) медь; Б) гидроксид натрия; В) бромид натрия.
В
7. Азотную кислоту получают в три стадии, окисляя атом азота по следующей схеме: А) N–3 →N+2 →N+4 → N+5 Б) N–3 →N0 →N+4 → N+5 В) N0 →N+2 →N+4 → N+5
А
1. Степень окисления азота в азотной кислоте равна: А) +5; Б) +4; В) -3.
А
2. При взаимодействии с какими веществами азотная кислота проявляет особые свойства, отличающие её от других кислот: А) основными оксидами; Б) металлами; В) основаниями.
Б
3. В окислительно-восстановительной реакции азотная кислота может участвовать в качестве: А) окислителя; Б) восстановителя; В) окислителя и восстановителя.
А
4. Какое из данных соединений азота называют чилийской селитрой: А) нитрат калия; Б) нитрат кальция; В) нитрат натрия;
В
5. Запишите уравнение взаимодействия меди с концентрированной азотной кислотой . Коэффициент перед формулой кислоты равен: А) 2; Б) 4; В) 1.
Б
6. Какое из перечисленных веществ не реагирует с разбавленной азотной кислотой: А) медь; Б) гидроксид натрия; В) бромид натрия.
В
7. Азотную кислоту получают в три стадии, окисляя атом азота по следующей схеме: А) N–3 →N+2 →N+4 → N+5 Б) N–3 →N0 →N+4 → N+5 В) N0 →N+2 →N+4 → N+5
А
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.