Презентация - Периодический закон и периодическая химических система элементов (ПСХЭ) Д.И. Менделеева
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 86%
- Слайдов: 30
- Просмотров: 567
- Скачиваний: 54
- Размер: 2 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Периодический закон Менделеева и периодическая система химических элементов
Периодический закон Менделеева и периодическая система химических элементов Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева Методическая разработка городского конкурса по химии «Наследие Дмитрия Ивановича Менделеева», посвященного 185-летию со дня рождения Д.И.Менделеева и 150-летию открытия периодического закона
Методическая разработка городского конкурса по химии «Наследие Дмитрия Ивановича Менделеева», посвященного 185-летию со дня рождения Д.И.Менделеева и 150-летию открытия периодического закона Периодическая система элементов
Периодическая система элементов Периодическая система Д.И.Менделеева (иследовательская работа)
Периодическая система Д.И.Менделеева (иследовательская работа) Периодический закон
Периодический закон Система взаимодействия уполномоченного по защите прав и законных интересов ребенка с субъектами образовательного процесса
Система взаимодействия уполномоченного по защите прав и законных интересов ребенка с субъектами образовательного процесса
Слайды и текст этой онлайн презентации
Слайд 1

Периодический закон и периодическая химических система элементов (ПСХЭ) Д.И. Менделеева
Слайд 2

Открытие Периодического закона и создание таблицы элементов – это действительно колоссальное научное достижение, заложившее основу современной химии и ядерной физики, позволившее четко систематизировать представления о природе и взаимодействии веществ.
Слайд 3

Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По мере открытия новых химических элементов, изучения состава и свойств их соединений появлялись первые попытки классифицировать элементы по каким-либо признакам. В общей сложности до Д.И. Менделеева было предпринято более 50 попыток классификации химических элементов. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов, выявляющей природу их сходства и различия, имеющей предсказательный характер.
Слайд 4

Иоганн Вольфгант Дёберейнер, 1817г
Сгруппировал химические элементы со сходными веществами по правилам триад- масса атома среднего химического элемента в каждой триаде равна среднеарифметической величине из масс атомов крайних.
Сгруппировал химические элементы со сходными веществами по правилам триад- масса атома среднего химического элемента в каждой триаде равна среднеарифметической величине из масс атомов крайних.
Слайд 5

Леопольд Гмелин, 1843г
Опубликовал таблицу химических элементов, расставленных по группам в порядке возрастания «соединительных масс». Вверху таблицы Л. Гмелин поместил три «базисных» элемента: кислород, азот и водород. Под этими химическими элементами ученый расположил триады, тетрады и пентады химических элементов.
Опубликовал таблицу химических элементов, расставленных по группам в порядке возрастания «соединительных масс». Вверху таблицы Л. Гмелин поместил три «базисных» элемента: кислород, азот и водород. Под этими химическими элементами ученый расположил триады, тетрады и пентады химических элементов.
Слайд 6

Макс фон Петтенкофер, 1850г
Предложил найти у химических элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т. е. в рядах соединений, отличающихся друг от друга на гомологическую разницу СН2. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную восьми. На этом основании М. Петтенкофер высказал предположение, что элементы являются сложными образованиями каких-либо субэлементарных частиц. Такого же мнения придерживался французский химик Ж. Дюма.
Предложил найти у химических элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т. е. в рядах соединений, отличающихся друг от друга на гомологическую разницу СН2. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную восьми. На этом основании М. Петтенкофер высказал предположение, что элементы являются сложными образованиями каких-либо субэлементарных частиц. Такого же мнения придерживался французский химик Ж. Дюма.
Слайд 7

Адольф Штреккер, 1859г
Опубликовал работу «Теория и практика определения атомных весов», в которой детально разработал дифференциальную систему химических элементов, описывающую закономерности в изменении их атомных масс. Отмеченные А. Штреккером закономерности в изменении атомных масс стали важной предпосылкой для создания периодической системы химических элементов.
Опубликовал работу «Теория и практика определения атомных весов», в которой детально разработал дифференциальную систему химических элементов, описывающую закономерности в изменении их атомных масс. Отмеченные А. Штреккером закономерности в изменении атомных масс стали важной предпосылкой для создания периодической системы химических элементов.
Слайд 8

Александр Эмиль Бегуйе де Шанкуртуа, 1862г
Он связал свойства элементов с функцией чисел и расположил все вокруг цилиндра по спирали. Соответственно, его таблица получила название «Земная спираль». А. Шанкуртуа нанес на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие атомным массам химических элементов.
Он связал свойства элементов с функцией чисел и расположил все вокруг цилиндра по спирали. Соответственно, его таблица получила название «Земная спираль». А. Шанкуртуа нанес на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие атомным массам химических элементов.
Слайд 9

A. Шанкуртуа был одним из первых ученых, отметивших периодичность свойств химических элементов; его винтовой график действительно фиксирует закономерные отношения между атомными массами элементов. Но установив некоторые соотношения между атомными массами элементов и их физико-химическими свойствами, А. Шанкуртуа не смог на основе своей «винтовой линии» подняться до закономерного обобщения –открытия Периодического закона.
Слайд 10

Джон Ньюлендс, 1864г
Опубликовал таблицу химических элементов, отражающую так называемый «закон октав». Ученый считал, что в ряду элементов, расположенных в порядке возрастания их атомных весов, свойства восьмого элемента сходны со свойствами первого. Например, такой октавой был ряд элементов: H (до), Li (ре), Be (ми), B (фа), C (соль), N (ля), O (си) [3]. Действительно, такая зависимость верна, но только для легких элементов.
Опубликовал таблицу химических элементов, отражающую так называемый «закон октав». Ученый считал, что в ряду элементов, расположенных в порядке возрастания их атомных весов, свойства восьмого элемента сходны со свойствами первого. Например, такой октавой был ряд элементов: H (до), Li (ре), Be (ми), B (фа), C (соль), N (ля), O (си) [3]. Действительно, такая зависимость верна, но только для легких элементов.
Слайд 11

Уильям Одлинг, 1857г
Составил таблицу, в которой 49 элементов были размещены в девяти группах. Спустя четыре года эта классификация была несколько усовершенствована ее автором. Все элементы, сходные по своим физико-химическим свойствам, У. Одлинг объединил в триады, тетрады и пентады. За пределами этих объединений остались водород, бор и олово. В 1868 г. У. Одлинг опубликовал таблицу элементов, которая имела недостатки: во-первых, в таблице фигурировали всего 45 элементов из 62 известных к тому времени; во-вторых, в таблице присутствовали необоснованные изъятия. Например, имелись обозначения: «Mn и прочие». В этом случае под «прочими» английский ученый подразумевал железо, кобальт, никель и медь.
Составил таблицу, в которой 49 элементов были размещены в девяти группах. Спустя четыре года эта классификация была несколько усовершенствована ее автором. Все элементы, сходные по своим физико-химическим свойствам, У. Одлинг объединил в триады, тетрады и пентады. За пределами этих объединений остались водород, бор и олово. В 1868 г. У. Одлинг опубликовал таблицу элементов, которая имела недостатки: во-первых, в таблице фигурировали всего 45 элементов из 62 известных к тому времени; во-вторых, в таблице присутствовали необоснованные изъятия. Например, имелись обозначения: «Mn и прочие». В этом случае под «прочими» английский ученый подразумевал железо, кобальт, никель и медь.
Слайд 12

Слайд 13
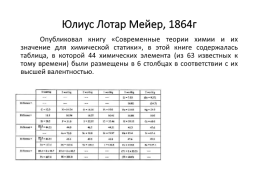
Юлиус Лотар Мейер, 1864г
Опубликовал книгу «Современные теории химии и их значение для химической статики», в этой книге содержалась таблица, в которой 44 химических элемента (из 63 известных к тому времени) были размещены в 6 столбцах в соответствии с их высшей валентностью.
Опубликовал книгу «Современные теории химии и их значение для химической статики», в этой книге содержалась таблица, в которой 44 химических элемента (из 63 известных к тому времени) были размещены в 6 столбцах в соответствии с их высшей валентностью.
Слайд 14

Следующую таблицу Ю. Мейер предложил в вышедшей в 1870 г. статье, которая содержала также график зависимости атомного объема элемента от атомного веса, имеющий характерный пилообразный вид. Таблица «Природа элементов как функция их атомного веса» состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Ю. Мейер оставил не заполненными.
Слайд 15

Открытие Периодического закона
В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака: величину атомной массы и свойства образованных химическими элементами веществ. Он выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях. Сопоставляя эти сведения, ученый составил естественные группы сходных по свойствам элементов. При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают), затем после резкого скачка повторяются периодически, т.е. через определённое число элементов встречаются сходные.
В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака: величину атомной массы и свойства образованных химическими элементами веществ. Он выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях. Сопоставляя эти сведения, ученый составил естественные группы сходных по свойствам элементов. При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают), затем после резкого скачка повторяются периодически, т.е. через определённое число элементов встречаются сходные.
Слайд 16

Что же было обнаружено?
При переходе от лития к фтору происходит закономерное ослабление металлических свойств и усиление неметаллических. При переходе от фтора к следующему по значению атомной массы элементу натрию происходит скачок в изменении свойств (Nа повторяет свойства Li) За Na следует Mg, который сходен с Ве - они проявляют металлические свойства. А1, следующий за Mg, напоминает В. Как близкие родственники, похожи Si и С; Р и N; S и О; С1 и F. При переходе к следующему за С1 элементу К опять происходит скачок в изменении и химических свойств.
Слайд 17

Периодическая закон
Д.И. Менделеева
Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном – аргон, то получим следующее расположение элементов: Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном – аргон, то получим следующее расположение элементов: Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
Слайд 18

Периодическая закон
Д.И. Менделеева
Li Be B C N O F Ne Na Mg Al Si P S Cl Ar При таком расположении в вертикальные столбики попадают элементы, сходные по своим свойствам.
Li Be B C N O F Ne Na Mg Al Si P S Cl Ar При таком расположении в вертикальные столбики попадают элементы, сходные по своим свойствам.
Слайд 19

Первый вариант Периодической таблицы
На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной своей формулировке звучал так: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной своей формулировке звучал так: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Слайд 20

Периодическая таблица
Д.И. Менделеева
Уязвимым моментом периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с увеличением относительной атомной массы их атомов. Более того, несколько пар элементов расположены в Периодической системе с нарушением увеличения атомной массы. Например, аргон с относительной атомной массой 39,948 занимает 18-е место, а калий с относительной атомной массой 39,102 имеет порядковый номер 19.
Ar
К
калий
аргон
39,102
39,948
Уязвимым моментом периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с увеличением относительной атомной массы их атомов. Более того, несколько пар элементов расположены в Периодической системе с нарушением увеличения атомной массы. Например, аргон с относительной атомной массой 39,948 занимает 18-е место, а калий с относительной атомной массой 39,102 имеет порядковый номер 19.
Ar
К
калий
аргон
39,102
39,948
Слайд 21

Периодический закон
Д.И. Менделеева
Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что в Периодической системе расположены в порядке увеличения положительного заряда их атомных ядер. С этой точки зрения никакого нарушения в последовательности элементов 18Ar – 19K, 27Co – 28Ni, 52Te – 53I, 90Th – 91Pa не существует. Следовательно, современная трактовка Периодического закона звучит следующим образом: Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от величины заряда их атомных ядер.
Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что в Периодической системе расположены в порядке увеличения положительного заряда их атомных ядер. С этой точки зрения никакого нарушения в последовательности элементов 18Ar – 19K, 27Co – 28Ni, 52Te – 53I, 90Th – 91Pa не существует. Следовательно, современная трактовка Периодического закона звучит следующим образом: Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от величины заряда их атомных ядер.
Слайд 22

Значение периодического закона
Д. И. Менделеев предсказывал свойства еще не открытых элементов, оставляя пустые ячейки в Периодической таблице, прогнозируя открытия соответствующих элементов. В историческом аспекте его прогнозы довольно быстро полностью подтвердилось. И эти исторические события ярко и отчетливо демонстрируют гениальность Д. И. Менделеева. Периодический закон позволил Д. И. Менделееву, оперировавшему 63 известными тогда элементами, шаг за шагом исправить атомные веса 11 из них. Далее, уже в 1875 г., французский химик П. Лекок де Буабодран открыл галлий, который оказался предсказанным Д. И. Менделеевым «экаалюминием». В 1879 г. Л. Нильсон открыл новый элемент – скандий, который оказался предсказанным Дмитрием Ивановичем «экабором». В 1885 г. К. Винклер открыл новый элемент германий, который оказался предсказанным «экасилицием». Из 29 предсказанных элементов Менделеев с удивительной точностью описал 12. При этом подробности свойств относились не только к простым веществам, но и к их соединениям. Открытие новых химических элементов позволило в свое время Д. И. Менделееву защитить право на открытие Периодического закона, поскольку этими открытиями подтвердились его предсказания.
Д. И. Менделеев предсказывал свойства еще не открытых элементов, оставляя пустые ячейки в Периодической таблице, прогнозируя открытия соответствующих элементов. В историческом аспекте его прогнозы довольно быстро полностью подтвердилось. И эти исторические события ярко и отчетливо демонстрируют гениальность Д. И. Менделеева. Периодический закон позволил Д. И. Менделееву, оперировавшему 63 известными тогда элементами, шаг за шагом исправить атомные веса 11 из них. Далее, уже в 1875 г., французский химик П. Лекок де Буабодран открыл галлий, который оказался предсказанным Д. И. Менделеевым «экаалюминием». В 1879 г. Л. Нильсон открыл новый элемент – скандий, который оказался предсказанным Дмитрием Ивановичем «экабором». В 1885 г. К. Винклер открыл новый элемент германий, который оказался предсказанным «экасилицием». Из 29 предсказанных элементов Менделеев с удивительной точностью описал 12. При этом подробности свойств относились не только к простым веществам, но и к их соединениям. Открытие новых химических элементов позволило в свое время Д. И. Менделееву защитить право на открытие Периодического закона, поскольку этими открытиями подтвердились его предсказания.
Слайд 23

В начале XX в. Периодическая система элементов неоднократно видоизменялась для приведения в соответствие с новейшими научными данными. В 1900 г. Дмитрий Менделеев и Уильям Рамзай, открывший инертные газы, пришли к выводу о необходимости включения в периодическую систему элементов особой, нулевой группы.
Благодаря открытию сложного строения атома, радиоактивности, развитию квантовой механики Периодический закон получил квантово-механическое обоснование и начался синтез искусственных элементов. Таблица элементов, найденных в природе, кончается 92-м элементом ураном (U). Открытый в 1940 г. нептуний (Np, Z = 93) был первым искусственно полученным трансурановым элементом.
В 30-х гг. ХХ в. велись интенсивные исследования искусственных радиоактивных веществ, в частности продуктов бомбардировки нейтронами урана.
Слайд 24

Периодическая таблица
химических элементов
Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие (IV,V,VI), VII-незаконченный. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие (IV,V,VI), VII-незаконченный. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
Слайд 25

Периодическая таблица
химических элементов
Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы. Различают главные (А) и побочные подгруппы (Б). Главные подгруппы состоят из элементов малых и больших периодов. Побочные подгруппы состоят из элементов только больших периодов.
Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы. Различают главные (А) и побочные подгруппы (Б). Главные подгруппы состоят из элементов малых и больших периодов. Побочные подгруппы состоят из элементов только больших периодов.
Слайд 26

Окислительно-восстановительные
свойства
Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства простых веществ и их соединений, то металлические свойства простых веществ элементов главных подгрупп возрастают, в периодах – убывают, а неметаллические – соответственно, наоборот – в главных подгруппах убывают, а в периодах – возрастают.
Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства простых веществ и их соединений, то металлические свойства простых веществ элементов главных подгрупп возрастают, в периодах – убывают, а неметаллические – соответственно, наоборот – в главных подгруппах убывают, а в периодах – возрастают.
Слайд 27
Окислительно-восстановительные
свойства
Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают, в периодах – уменьшаются. Окислительные (способность принимать электроны), наоборот, - в главных подгруппах уменьшаются, в периодах – возрастают.
Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают, в периодах – уменьшаются. Окислительные (способность принимать электроны), наоборот, - в главных подгруппах уменьшаются, в периодах – возрастают.
Слайд 28

Электроотрицательность
Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо. В группе с увеличением числа электронных слоев электроотрицательность уменьшается, то есть сверху вниз. Значит самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr).
Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо. В группе с увеличением числа электронных слоев электроотрицательность уменьшается, то есть сверху вниз. Значит самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr).
Слайд 29

Изменение радиуса атома в периоде
Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром электронных оболочек усиливается. В начале периода расположены элементы с небольшим числом электронов на внешнем электронном слое и большим радиусом атома. Электроны, находящиеся дальше от ядра, легко от него отрываются, что характерно для элементов-металлов.
Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром электронных оболочек усиливается. В начале периода расположены элементы с небольшим числом электронов на внешнем электронном слое и большим радиусом атома. Электроны, находящиеся дальше от ядра, легко от него отрываются, что характерно для элементов-металлов.
Слайд 30

Изменение радиуса атома в группе
В одной и той же группе с увеличением номера периода атомные радиусы возрастают. Атомы металлов сравнительно легко отдают электроны и не могут их присоединять для достраивания своего внешнего электронного слоя.
В одной и той же группе с увеличением номера периода атомные радиусы возрастают. Атомы металлов сравнительно легко отдают электроны и не могут их присоединять для достраивания своего внешнего электронного слоя.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
