Презентация - Опорный конспект по изопроцессам
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 90%
- Слайдов: 26
- Просмотров: 3307
- Скачиваний: 1383
- Размер: 1.97 MB
- Класс: 11
- Формат: ppt / pptx
Примеры похожих презентаций
 Опорный конспект Кислоты
Опорный конспект Кислоты Опорные конспекты для подготовки к ОГЭ по русскому языку
Опорные конспекты для подготовки к ОГЭ по русскому языку Опорный конспект «типы речи»
Опорный конспект «типы речи» Опорные конспекты по теме «Имя числительное»
Опорные конспекты по теме «Имя числительное» Конспект-презентация занятия по развитию лексико-грамматических категорий и связной речи в старшей группе по теме «Овощи»
Конспект-презентация занятия по развитию лексико-грамматических категорий и связной речи в старшей группе по теме «Овощи» Путешествие по сказкам К.И. Чуковского (конспект)
Путешествие по сказкам К.И. Чуковского (конспект) Конспект интегрированной непосредственно образовательной деятельности с детьми подготовительного дошкольного возраста на тему: «Викторина по сказкам А.С. Пушкина»
Конспект интегрированной непосредственно образовательной деятельности с детьми подготовительного дошкольного возраста на тему: «Викторина по сказкам А.С. Пушкина»
Слайды и текст этой онлайн презентации
Слайд 1

Опорный конспект по изопроцессам. Эпиграф к уроку: «...Может собственных Платонов И быстрых разумом Невтонов Российская земля рождать» М. В. Ломоносов (1711 – 1765 г.г.)
Слайд 2

Цели: 1. Образовательные: познакомить учащихся с газовыми законами; обобщить и систематизировать знания учащихся о свойствах газов. 2. Развивающие: создать условия для развития познавательного интереса учащихся. активизация мыслительной деятельности развитие умений сравнивать, выявлять закономерности, обобщать, логически мыслить 3. Воспитательные: продолжить формирование познавательного интереса учащихся; содействовать формированию у учащихся осознавать собственную учебную деятельность.
Слайд 3

Что является объектом изучения МКТ?
Идеальный газ.
Что в МКТ называется идеальным газом?
Идеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь.
Какие три термодинамических параметра используют для того, чтобы описать состояние идеального газа?
Давление, объем и температура.
Какое уравнение связывает между собой все три термодинамических параметра?
Уравнение состояния идеального газа.
Актуализация знаний
Что вы понимаете под параметрами состояния?
Параметры, описывающие состояние идеального газа
Слайд 4

Макроскопические параметры
Параметры, характеризующие состояние газа без учета его молекулярного строения, называются макроскопическими. ? Назовите эти параметры.
Параметры, характеризующие состояние газа без учета его молекулярного строения, называются макроскопическими. ? Назовите эти параметры.
Слайд 5

P
давление
V объем
T температура
V объем
T температура
Слайд 6

Изопроцессы
6
Процессы, протекающие в термодинамической системе при одном неизменном макроскопическом параметре когда два других изменяются, называются изопроцессами. Изопроцесс – это идеализированная модель реального процесса, которая только приближённо отражает действительность
6
Процессы, протекающие в термодинамической системе при одном неизменном макроскопическом параметре когда два других изменяются, называются изопроцессами. Изопроцесс – это идеализированная модель реального процесса, которая только приближённо отражает действительность
Слайд 7
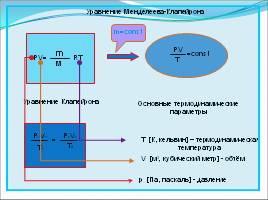
Уравнение Менделеева-Клапейрона
PV=
m
M
RT
PV
T
=const
Уравнение Клапейрона
P1V1
T1
=
P2V2
T2
Основные термодинамические параметры
p [Па, паскаль] - давление
V [м3, кубический метр] - объём
Т [К, кельвин] – термодинамическая температура
m=const
PV=
m
M
RT
PV
T
=const
Уравнение Клапейрона
P1V1
T1
=
P2V2
T2
Основные термодинамические параметры
p [Па, паскаль] - давление
V [м3, кубический метр] - объём
Т [К, кельвин] – термодинамическая температура
m=const
Слайд 8
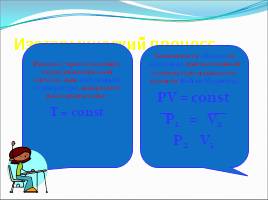
Изотермический процесс
Процесс, протекающий в термодинамической системе при постоянной температуре, называется изотермическим. T = const
Зависимость объема от давления при постоянной температуре называется законом Бойля-Мариотта. PV = const P1 = V2 P2 V1
Процесс, протекающий в термодинамической системе при постоянной температуре, называется изотермическим. T = const
Зависимость объема от давления при постоянной температуре называется законом Бойля-Мариотта. PV = const P1 = V2 P2 V1
Слайд 9

Изотермический (закон Бойля – Мариотта)
Роберт Бойль (1627—1691) был тринадцатым ребенком из четырнадцати детей Ричарда Бойля — первого герцога Коркского, свирепого и удачливого стяжателя, жившего во времена королевы Елизаветы и умножившего свои угодья захватом чужих земель. Он родился в Лисмор Касле, одном из ирландских поместий отца. Там Роберт провел свое детство. Он получил превосходное домашнее образование и в возрасте восьми лет стал студентом Итонского университета. Там он проучился четыре года, после чего уехал в новое поместье отца — Столбридж. Как было принято в то время, в возрасте двенадцати лет Роберта вместе с братом отправили в путешествие по Европе. Он решил продолжить образование в Швейцарии и Италии и пробыл там долгие шесть лет. В Англию Бойль вернулся только в 1644 году, уже после смерти отца, который оставил ему значительное состояние.
Роберт Бойль (1627—1691) был тринадцатым ребенком из четырнадцати детей Ричарда Бойля — первого герцога Коркского, свирепого и удачливого стяжателя, жившего во времена королевы Елизаветы и умножившего свои угодья захватом чужих земель. Он родился в Лисмор Касле, одном из ирландских поместий отца. Там Роберт провел свое детство. Он получил превосходное домашнее образование и в возрасте восьми лет стал студентом Итонского университета. Там он проучился четыре года, после чего уехал в новое поместье отца — Столбридж. Как было принято в то время, в возрасте двенадцати лет Роберта вместе с братом отправили в путешествие по Европе. Он решил продолжить образование в Швейцарии и Италии и пробыл там долгие шесть лет. В Англию Бойль вернулся только в 1644 году, уже после смерти отца, который оставил ему значительное состояние.
Слайд 10

Изотермический (закон Бойля – Мариотта)
Слайд 11
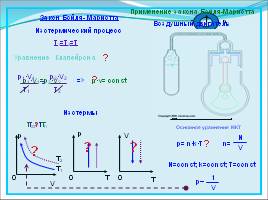
Закон Бойля- Мариотта
Изотермический процесс
T1=T2=T
p·v= const
p1·V1=p2·V2
p
V
0
p
0
T
V
0
T
V1
V2
p1
p2
Изотермы
p1·V1
T1
=
p2·V2
T2
T2
T1
T2>T1
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; T=const
р~
1
V
Применение закона Бойля-Мариотта Воздушный двигатель
?
=>
?
?
?
T2 ? T1
?
Уравнение Клапейрона
?
Изотермический процесс
T1=T2=T
p·v= const
p1·V1=p2·V2
p
V
0
p
0
T
V
0
T
V1
V2
p1
p2
Изотермы
p1·V1
T1
=
p2·V2
T2
T2
T1
T2>T1
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; T=const
р~
1
V
Применение закона Бойля-Мариотта Воздушный двигатель
?
=>
?
?
?
T2 ? T1
?
Уравнение Клапейрона
?
Слайд 12
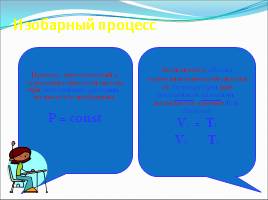
Изобарный процесс
Процесс, протекающий в термодинамической системе при постоянном давлении, называется изобарным. Р = const
Зависимость объема термодинамической системы от температуры при постоянном давлении, называется законом Гей-Люссака V1 = T1 V2 T2
Процесс, протекающий в термодинамической системе при постоянном давлении, называется изобарным. Р = const
Зависимость объема термодинамической системы от температуры при постоянном давлении, называется законом Гей-Люссака V1 = T1 V2 T2
Слайд 13

Изобарный (закон Гей – Люссака)
Слайд 14
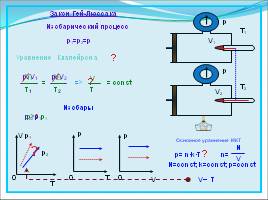
Закон Гей-Люссака
Изобарический процесс
p1=p2=p
= const
V
T
0
p
0
T
p
0
V
V1
V2
p
p
Изобары
p1V1
T1
=
p2V2
T2
V
T
V1
T1
V2
T2
=
T1
T2
=>
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; p=const
V~
T
?
p2>p1
p2 ? p1
p2
p1
?
?
Уравнение Клапейрона
?
Изобарический процесс
p1=p2=p
= const
V
T
0
p
0
T
p
0
V
V1
V2
p
p
Изобары
p1V1
T1
=
p2V2
T2
V
T
V1
T1
V2
T2
=
T1
T2
=>
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; p=const
V~
T
?
p2>p1
p2 ? p1
p2
p1
?
?
Уравнение Клапейрона
?
Слайд 15
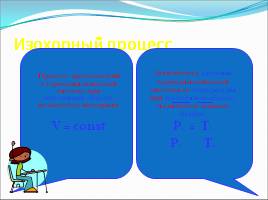
Изохорный процесс
Процесс, протекающий в термодинамической системе при постоянном объеме, называется изохорным. V = const
Зависимость давления термодинамической системы от температуры при постоянном объеме, называется законом Шарля. P1 = T1 P2 T2
Процесс, протекающий в термодинамической системе при постоянном объеме, называется изохорным. V = const
Зависимость давления термодинамической системы от температуры при постоянном объеме, называется законом Шарля. P1 = T1 P2 T2
Слайд 16

Изохорный (закон Шарля)
Слайд 17
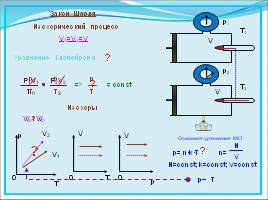
Закон Шарля
Изохорический процесс
V1=V2=V
= const
p
T
0
V
0
T
V
0
p
V
V
p1
p2
Изохоры
P1V1
T1
=
P2V2
T2
p
T
p1
T1
p2
T2
=
T1
T2
=>
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; V=const
p~
T
?
?
V1
V2
V1>V2
V2 ? V1
?
Уравнение Клапейрона
?
Изохорический процесс
V1=V2=V
= const
p
T
0
V
0
T
V
0
p
V
V
p1
p2
Изохоры
P1V1
T1
=
P2V2
T2
p
T
p1
T1
p2
T2
=
T1
T2
=>
Основное уравнение МКТ
p= n·k·T
n=
N
V
N=const; k=const; V=const
p~
T
?
?
V1
V2
V1>V2
V2 ? V1
?
Уравнение Клапейрона
?
Слайд 18
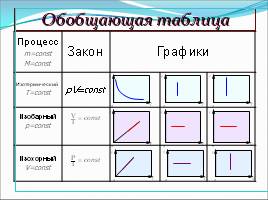
Обобщающая таблица
Процесс m=const M=const Закон Графики Графики Графики
Изотермический T=const pV=const
Изобарный p=const
Изохорный V=const
V
T
--
=
const
P
T
const
=
Процесс m=const M=const Закон Графики Графики Графики
Изотермический T=const pV=const
Изобарный p=const
Изохорный V=const
V
T
--
=
const
P
T
const
=
Слайд 19
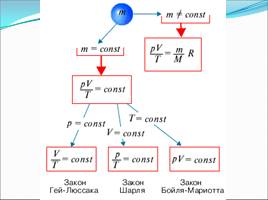
Слайд 20

Подведем итог:
P1 = V2 T = const, закон Бойля- Мариотта P2 V1 P1 = T1 V = const, закон Шарля P2 =T2 V1 = T1 Р = const, закон Гей-Люссака V2 T2
P1 = V2 T = const, закон Бойля- Мариотта P2 V1 P1 = T1 V = const, закон Шарля P2 =T2 V1 = T1 Р = const, закон Гей-Люссака V2 T2
Слайд 21

Следствия из уравнения состояния закон Авогадро:
N=pV/kT при равных давлениях и температуре в одинаковых объёмах любых газов содержится одинаковое число молекул
N=pV/kT при равных давлениях и температуре в одинаковых объёмах любых газов содержится одинаковое число молекул
Слайд 22

закон Дальтона
Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
Слайд 23
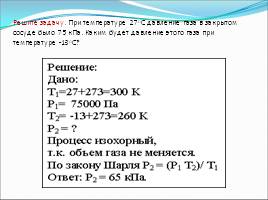
Решите задачу. При температуре 27oС давление газа в закрытом сосуде было 75 кПа. Каким будет давление этого газа при температуре -13oС?
Слайд 24

Домашнее задание:
§69; повт. § § 65-68;
упражнение 13 №1;
Сборник задач А.П. Рымкевич №527; №536
Слайд 25

Прошу Вас оценить урок, насколько он был успешен.
Мне все понравилось
Мне ничего не понравилось
Мне ничего не понятно
Мне было интересно
Мне было скучно
Мне было легко
Мне было трудно
Я узнал много нового
Я не узнал ничего нового
Слайд 26

Источники информации
1. Диск «Физика 7-11 классы. Библиотека наглядных пособий» из серии 1С: Образование, 2003-2006 2. Программы для общеобразовательных учреждений. Г.Я. Мякишев. Физика. Астрономия. 7-11 кл.-М.: Дрофа,2002 3. Г. Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский. Физика. Учебник для 10 кл. Москва: Просвещение,2007.-366 с. 4. Поурочные планы по учебнику Г.Я. Мякишева и др. Сост. И.И. Мокрова.-Волгоград: Учитель-АСТ, 2005.-112 с.
1. Диск «Физика 7-11 классы. Библиотека наглядных пособий» из серии 1С: Образование, 2003-2006 2. Программы для общеобразовательных учреждений. Г.Я. Мякишев. Физика. Астрономия. 7-11 кл.-М.: Дрофа,2002 3. Г. Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский. Физика. Учебник для 10 кл. Москва: Просвещение,2007.-366 с. 4. Поурочные планы по учебнику Г.Я. Мякишева и др. Сост. И.И. Мокрова.-Волгоград: Учитель-АСТ, 2005.-112 с.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
