Слайды и текст этой онлайн презентации
Слайд 1
МАОУ «ЭКСПЕРИМЕНТАЛЬНЫЙ ЛИЦЕЙ «Научно-образовательный комплекс»
КИСЛОТЫ
Колыванова Лариса Михайловна, учитель химии
Слайд 2
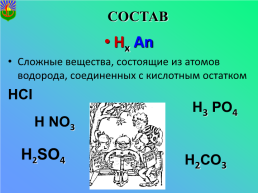
СОСТАВ
Hх Аn
Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком
НСI
Н3 РО4
Н NО3
Н2SО4
Н2СО3
Слайд 3
КИСЛОТЫ - это вкусно
Слайд 4
КИСЛОТЫ – это важно
Объём продукции желудочного сока
В сутки в желудке взрослого человека вырабатывается около 2 л желудочного сока.
Базальная (то есть в состоянии покоя, не стимулированная пищей, химическим стимуляторами и т.п.) секреция у мужчин составляет (у женщин на 25—30 % меньше):
желудочного сока — 80—100 мл/ч;
соляной кислоты — 2,5—5,0 ммоль/ч;
пепсина — 20—35 мг/ч.
Максимальная продукция соляной кислоты у мужчин 22—29 ммоль/ч, у женщин — 16—21 ммоль/ч.
Соляная кислота HCl
Слайд 5
КИСЛОТЫ – это опасно
КИСЛОТЫ — едкие вещества, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Они поражают кожу, слизистые оболочки, дыхательные пути
Слайд 6
КЛАССИФИКАЦИЯ
Признаки
классификации.Группы кислот.Примеры
Наличие кислорода в кислотном остатке.А) кислородные
Б) бескислородные.А) H3PO4, H2SO4
Б) HBr, H2S
Основность.А) одноосновные
Б) многоосновные.А) HNO3, HCl
Б) H2SO4, H3PO4
Растворимость в воде.А) растворимые
Б) нерастворимые.А) HNO3, HCl
Б) H2SiO3
Слайд 7
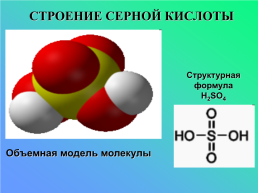
СТРОЕНИЕ СЕРНОЙ КИСЛОТЫ
Структурная формула
H2SO4
Объемная модель молекулы
Слайд 8
ХИМИЧЕСКИЕ СВОЙСВА
1.кислота + металл (стоящий до водорода в ЭХР напряжений)
2HCl + Mg →MgCl2 + H2
2.кислота + основный оксид
2HCl + MgO → MgCl2 + H2O
3. кислота + основание
HCl + NaOH → NaCl + H2O
4. кислота + соль
HCl +AgNO3 → AgCl + HNO3
Слайд 9
Взаимодействие кислот с индикаторами
Слайд 10
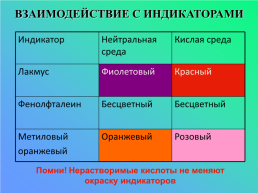
ВЗАИМОДЕЙСТВИЕ С ИНДИКАТОРАМИ
Индикатор.Нейтральная среда.Кислая среда
Лакмус.Фиолетовый.Красный
Фенолфталеин.Бесцветный.Бесцветный
Метиловый
оранжевый.Оранжевый.Розовый
Помни! Нерастворимые кислоты не меняют окраску индикаторов
Слайд 11
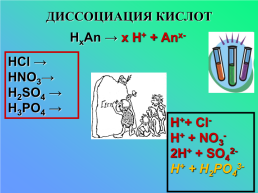
ДИССОЦИАЦИЯ КИСЛОТ
НxAn → x Н+ + Anx-
HCl →
HNO3→
H2SO4 →
H3PO4 →
H++ Cl-
H+ + NO3-
2H+ + SO42-
H+ + Н2PO43-
Слайд 12
ВЗАИМОДЕЙСТВИЕ КИСЛОТ С Ме
МЕТАЛЛ + КИСЛОТА→СОЛЬ + ВОДОРОД
левее
Pb + H2SO4 →Х ???
Слайд 13
ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
ОСНОВНЫЙ ОКСИД + КИСЛОТА → СОЛЬ + ВОДА
Слайд 14
ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ
ОСНОВАНИЕ + КИСЛОТА → СОЛЬ + ВОДА
Реакция между основанием и кислотой с образованием соли и воды называется реакцией нейтрализации
Слайд 15
ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
СОЛЬ + КИСЛОТА → НОВАЯ КИСЛОТА + НОВАЯ СОЛЬ
Реакция возможна, ЕСЛИ образуется ↓ или ↑
Слайд 16
ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 17
О КИСЛОТНЫХ ДОЖДЯХ
Оксиды азота, серы содержатся в выхлопных газах реактивных двигателей и двигателей внутреннего сгорания, отработанных газах металлургических и химических предприятий, теплоэлектростанций, которые неизбежно превращаются в кислоты и выпадают нам на голову в виде кислотных дождей
Слайд 18
О КИСЛОТНЫХ ДОЖДЯХ
Кислотные дожди виноваты в исчезновении рыбы во многих реках и озёрах, так как рыба не выдерживает кислой воды
Такие дожди вымывают из почвы питательные вещества, без которых растениям грозит голодная смерть
Многие растения погибают, если увеличивается кислотность почвы. Оксид серы, кроме того, прямо повреждает зелень
Слайд 19
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Диссоциация
Взаимодействие с индикаторами
Взаимодействие с металлами
Взаимодействие с основными оксидами
Взаимодействие с основаниями
Взаимодействие с солями
Слайд 20
«Воспоминание о лете» Погадаем на ромашке:
«Взаимодействует – не взаимодействует?»
Задание
С какими из веществ взаимодействует
серная кислота?
а) НСl д) Na
б) КОН e) P2O5
в) СuО ж)Cu
г) СО2 (2 балла.)
Составьте молекулярные и ионные уравнения возможных реакций к заданию 1 (3балла.)
Слайд 22
Какое свойство кислот?
Кислота, когда здорова, Угостить друзей готова Тем, что ей дала природа - Катионом водорода!
Слайд 23
ВЕК ЖИВИ- ВЕК УЧИСЬ
«Сами трудясь, вы многое сделаете для себя и для близких, а если при труде успеха не будет, будет неудача, не беда – попробуйте ещё»
Д.И. Менделеев
Остальные важные свойства
кислот представлены в приложенном файле «Опорный конспект Кислоты»
Слайд 24
ОТ ПЕРЕМЕНЫ МЕСТ СЛАГАЕМЫХ…?
 Опорные конспекты для подготовки к ОГЭ по русскому языку
Опорные конспекты для подготовки к ОГЭ по русскому языку Опорный конспект «типы речи»
Опорный конспект «типы речи» Опорные конспекты по теме «Имя числительное»
Опорные конспекты по теме «Имя числительное» Опорный конспект по изопроцессам
Опорный конспект по изопроцессам Урок-путешествие «Кислоты»
Урок-путешествие «Кислоты» Конспект-презентация занятия по развитию лексико-грамматических категорий и связной речи в старшей группе по теме «Овощи»
Конспект-презентация занятия по развитию лексико-грамматических категорий и связной речи в старшей группе по теме «Овощи» Викторина «Карбоновые кислоты»
Викторина «Карбоновые кислоты»