Презентация - Ионная связь
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 90%
- Слайдов: 21
- Просмотров: 3377
- Скачиваний: 738
- Размер: 1.35 MB
- Класс: 8
- Формат: ppt / pptx
Примеры похожих презентаций
 Химическая связь - Ионная химическая связь
Химическая связь - Ионная химическая связь Строение ароматических углеводородов - Ароматическая связь
Строение ароматических углеводородов - Ароматическая связь Артикуляционная гимнастика
Артикуляционная гимнастика Ковалентная неполярная связь
Ковалентная неполярная связь Задание по теме «Информационная обработка текста»
Задание по теме «Информационная обработка текста» Информационная компетентность учителя
Информационная компетентность учителя Нетрадиционная техника рисования
Нетрадиционная техника рисования
Слайды и текст этой онлайн презентации
Слайд 1

Тема: Ионная связь
Подготовила: Коноплева И.Н. Учитель химии МБОУ «СОШ №5»
Подготовила: Коноплева И.Н. Учитель химии МБОУ «СОШ №5»
Слайд 2

Проверим упр.4 к §8
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно поряд-ковому номеру элемента. Число энергети-ческих уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4. Схема строения атома кремния: Si +14 )2)8)4
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно поряд-ковому номеру элемента. Число энергети-ческих уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4. Схема строения атома кремния: Si +14 )2)8)4
Слайд 3

Вопрос на засыпку:
Какую особенность в строении имеют атомы инертных газов (He, Ne, Ar)? Атомы этих элементов практически не образуют соединений с другими атомами. С чем это может быть связано?
Какую особенность в строении имеют атомы инертных газов (He, Ne, Ar)? Атомы этих элементов практически не образуют соединений с другими атомами. С чем это может быть связано?
Слайд 4

Какие разные элементы!
Все остальные элементы
Имеют завершенные уровни, не взаимодействуют с другими атомами
Имеют незавершенные уровни, взаимодействуют с другими атомами, чтобы завершить свои энергетические уровни
Кто это?
А это кто?
Все остальные элементы
Имеют завершенные уровни, не взаимодействуют с другими атомами
Имеют незавершенные уровни, взаимодействуют с другими атомами, чтобы завершить свои энергетические уровни
Кто это?
А это кто?
Слайд 5

Атомы элементов - металлов
Если мало электронов на внешнем уровне – атом стремится их отдать Na +11 )2)8)1 Na+ +11 )2)8
атом натрия
ион натрия
Атомы элементов – металлов в ПС учебника обозначены черным, а также зеленым цветом
Если мало электронов на внешнем уровне – атом стремится их отдать Na +11 )2)8)1 Na+ +11 )2)8
атом натрия
ион натрия
Атомы элементов – металлов в ПС учебника обозначены черным, а также зеленым цветом
Слайд 6

Атомы элементов - неметаллов
Если внешний уровень близок к завершению (т.е. содержит 7, 6, или 5 электронов), атом стремится принять недостающие до 8 электроны Cl +17 )2)8)7 Сl- +17 )2)8)8
атом хлора
ион хлора
Атомы элементов – неметаллов в ПС обозначены красным цветом
Если внешний уровень близок к завершению (т.е. содержит 7, 6, или 5 электронов), атом стремится принять недостающие до 8 электроны Cl +17 )2)8)7 Сl- +17 )2)8)8
атом хлора
ион хлора
Атомы элементов – неметаллов в ПС обозначены красным цветом
Слайд 7

Итак…
Атомы металлов имеют тенденцию к отдаче электронов с внешнего уровня Атомы неметаллов имеют тенденцию к принятию недостающих до завершения внешнего уровня электронов.
Атомы металлов имеют тенденцию к отдаче электронов с внешнего уровня Атомы неметаллов имеют тенденцию к принятию недостающих до завершения внешнего уровня электронов.
Слайд 8

В периодах:
Металлические свойства ослабевают, а неметаллические усиливаются, так как: А) увеличиваются заряды атомных ядер; Б) увеличивается число электронов на внешнем уровне; В) число энергетических уровней постоянно; Г) радиус атома уменьшается; Д) способность к отдаче электронов ослабевает, а способность к принятию недостающих электронов возрастает.
Na Mg Al Si P S Cl
Металлические свойства ослабевают, а неметаллические усиливаются, так как: А) увеличиваются заряды атомных ядер; Б) увеличивается число электронов на внешнем уровне; В) число энергетических уровней постоянно; Г) радиус атома уменьшается; Д) способность к отдаче электронов ослабевает, а способность к принятию недостающих электронов возрастает.
Na Mg Al Si P S Cl
Слайд 9

Самый
Сильный
Неметалл!
В группах (главных подгруппах):
Металлические свойства усиливаются, а неметаллические ослабевают, так как: А) увеличиваются заряды атомных ядер; Б) число электронов на внешнем уровне постоянно; В) увеличивается число энергетических уровней; Г) увеличивается радиус атома; Д) способность к отдаче электронов возрастает, а способность к принятию недостающих электронов ослабевает.
Li Na K Rb Cs Fr
F Cl Br I At
Самый Сильный Металл!
щелочные металлы
г алогены
В группах (главных подгруппах):
Металлические свойства усиливаются, а неметаллические ослабевают, так как: А) увеличиваются заряды атомных ядер; Б) число электронов на внешнем уровне постоянно; В) увеличивается число энергетических уровней; Г) увеличивается радиус атома; Д) способность к отдаче электронов возрастает, а способность к принятию недостающих электронов ослабевает.
Li Na K Rb Cs Fr
F Cl Br I At
Самый Сильный Металл!
щелочные металлы
г алогены
Слайд 10
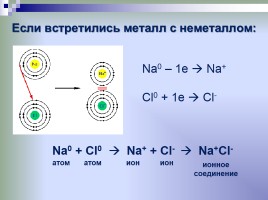
Если встретились металл с неметаллом:
Na0 – 1e Na+ Cl0 + 1e Cl-
Na0 + Cl0 Na+ + Cl- Na+Cl-
атом
атом
ион
ион
ионное соединение
Na0 – 1e Na+ Cl0 + 1e Cl-
Na0 + Cl0 Na+ + Cl- Na+Cl-
атом
атом
ион
ион
ионное соединение
Слайд 11
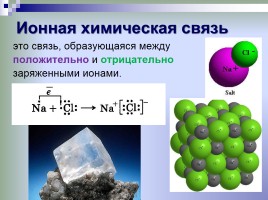
Ионная химическая связь
это связь, образующаяся между положительно и отрицательно заряженными ионами.
это связь, образующаяся между положительно и отрицательно заряженными ионами.
Слайд 12

Алгоритм составления схемы образования ионной связи.
Разберите алгоритм составления ионной связи на стр.57 §9 учебника. Пользуясь алгоритмом, составьте схемы образования ионной связи при взаимодействии: а) калия и кислорода; б) лития и хлора; в) магния и фтора.
Разберите алгоритм составления ионной связи на стр.57 §9 учебника. Пользуясь алгоритмом, составьте схемы образования ионной связи при взаимодействии: а) калия и кислорода; б) лития и хлора; в) магния и фтора.
Слайд 13

Подведем итоги:
1. Какие группы элементов мы выделили с точки зрения строения внешнего уровня их атомов? 2. Каким образом атомы металлов завершают свои уровни? А атомы неметаллов? 3. Как называются частицы, в которые превращаются атомы элементов, принимая или отдавая электроны? 4. Что такое ионная химическая связь, в каком случае она образуется?
1. Какие группы элементов мы выделили с точки зрения строения внешнего уровня их атомов? 2. Каким образом атомы металлов завершают свои уровни? А атомы неметаллов? 3. Как называются частицы, в которые превращаются атомы элементов, принимая или отдавая электроны? 4. Что такое ионная химическая связь, в каком случае она образуется?
Слайд 14

Задание №1:
Сравните металлические свойства элементов, поставив вместо знак «<» или «>»: Na K; Al Mg; Rb Sr; Na Cs; K Al Сравните неметаллические свойства элементов, поставив вместо знак «<» или «>»: S O; F P; Si C; P S; N O
Сравните металлические свойства элементов, поставив вместо знак «<» или «>»: Na K; Al Mg; Rb Sr; Na Cs; K Al Сравните неметаллические свойства элементов, поставив вместо знак «<» или «>»: S O; F P; Si C; P S; N O
Слайд 15

Проверьте себя:
Сравните металлические свойства элементов, поставив вместо знак «<» или «>»: Na < K; Al < Mg; Rb > Sr; Na > Cs; K > Al Сравните неметаллические свойства элементов, поставив вместо знак «<» или «>»: S < O; F > P; Si < C; P < S; N < O
Каждый правильно поставленный знак – 1 балл (всего 10 баллов!)
Сравните металлические свойства элементов, поставив вместо знак «<» или «>»: Na < K; Al < Mg; Rb > Sr; Na > Cs; K > Al Сравните неметаллические свойства элементов, поставив вместо знак «<» или «>»: S < O; F > P; Si < C; P < S; N < O
Каждый правильно поставленный знак – 1 балл (всего 10 баллов!)
Слайд 16

Задание №2:
Расположите элементы в порядке уменьшения их металлических свойств: а) Al, Na, K, B, Bа, Mg б) Na, Rb, Mg, Ca, Cs, Al Расположите элементы в порядке уменьшения их неметаллических свойств: а) C, S, Si, O, P, Cl, F б) Si, N, P, Cl, Br, As, S
Расположите элементы в порядке уменьшения их металлических свойств: а) Al, Na, K, B, Bа, Mg б) Na, Rb, Mg, Ca, Cs, Al Расположите элементы в порядке уменьшения их неметаллических свойств: а) C, S, Si, O, P, Cl, F б) Si, N, P, Cl, Br, As, S
Слайд 17

Проверьте себя:
Расположите элементы в порядке уменьшения их металлических свойств: а) K > Bа > Nа > Mg > Al > B б) Cs > Rb > Ca > Na > Mg > Al Расположите элементы в порядке уменьшения их неметаллических свойств: а) F > O > Cl > S > C > P > Si б) N > Cl > Br > S > P > As > Si
2 балла за каждую полностью правильно составленную последовательность (всего 8 баллов)
Расположите элементы в порядке уменьшения их металлических свойств: а) K > Bа > Nа > Mg > Al > B б) Cs > Rb > Ca > Na > Mg > Al Расположите элементы в порядке уменьшения их неметаллических свойств: а) F > O > Cl > S > C > P > Si б) N > Cl > Br > S > P > As > Si
2 балла за каждую полностью правильно составленную последовательность (всего 8 баллов)
Слайд 18

Поставьте себе оценку:
Общее количество баллов за 2 задания – 18; Подсчитайте набранное вами общее количество баллов за 2 задания. Поставьте «5» за 15 - 18 баллов; Поставьте «4» за 11 - 14 баллов.
Общее количество баллов за 2 задания – 18; Подсчитайте набранное вами общее количество баллов за 2 задания. Поставьте «5» за 15 - 18 баллов; Поставьте «4» за 11 - 14 баллов.
Слайд 19
Поставьте на карточках “+”, если вы с этим утверждением согласны:
мне было комфортно на уроке я получил ответ на все интересую-щие меня вопросы я принимал активное участие во всех этапах урока я получил новые знания на уроке я работал в команде и помог ей
РЕФЛЕКСИЯ:
мне было комфортно на уроке я получил ответ на все интересую-щие меня вопросы я принимал активное участие во всех этапах урока я получил новые знания на уроке я работал в команде и помог ей
РЕФЛЕКСИЯ:
Слайд 20

Домашнее задание:
§10, составьте схемы образования ионной связи для элементов с порядковыми номерами: а) 19 и 16; б) 12 и 35.
СПАСИБО ЗА РАБОТУ!
§10, составьте схемы образования ионной связи для элементов с порядковыми номерами: а) 19 и 16; б) 12 и 35.
СПАСИБО ЗА РАБОТУ!
Слайд 21

Комплект уроков
«ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ»
к учебнику О.С.Габриеляна для 8 класса
разработан учителем химии
МАОУ Лицей№33
«Физико-математический»
г.Ростова-на-Дону
Лоренц Ириной Григорьевной
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
