Презентация - Фосфор и его соединения
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 93%
- Слайдов: 36
- Просмотров: 7669
- Скачиваний: 3310
- Размер: 2.78 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Его названье – светлый,
Он ядовитый и горюч.
Есть аллотрон его известный,
Безвредный, как сургуч.
Он очень нужен всем растеньям,
В природных минералах есть
Относят соли к удобреньям,
Которых в РФ не счесть.
Слайд 2

То красный он, то белый,
То черным станет вдруг,
То ядовитый, вредный,
А то наш лучший друг.
А вот собака мчится.
О, ужас! Не смотри!
Во тьме она светится,
в глазах её огни.
Но кто же ты? Ответь нам.
И где тебя найти?
«Стою в ряду я третьем,
Ты там меня ищи!»
Слайд 3

Фосфор и его
соединения
Слайд 4

Цель и задачи:
Изучить строение атома фосфора. Нахождение в природе. Физические и химические свойства. Получение. Применение. Соединения фосфора.
Изучить строение атома фосфора. Нахождение в природе. Физические и химические свойства. Получение. Применение. Соединения фосфора.
Слайд 5

«… Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из её отвёрстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь…
Я дотронулся до этой светящейся головы и, отняв руку увидел, что мои пальцы тоже засветились в темноте.
- Фосфор, - сказал я».
Артур Конан Дойль:
«Собака Баскервилей».
Слайд 6

Химический знак – Р
2. Название - ФОСФОР
3. Порядковый номер - 15
4. Ar (Р) = 31
5. 3 период
6. VA группа
Слайд 7

P
+15
31
2
5
8
1s2
2s2
2p6
3s2
3p3
3d0
р+ =15; е- = 15; n0 = 16 Степени окисления от –3 ; 0. Валентности - III (низшая).
Строение атома фосфора:
1s2 |2s22p6 |3s23p33d°
+15
31
2
5
8
1s2
2s2
2p6
3s2
3p3
3d0
р+ =15; е- = 15; n0 = 16 Степени окисления от –3 ; 0. Валентности - III (низшая).
Строение атома фосфора:
1s2 |2s22p6 |3s23p33d°
Слайд 8
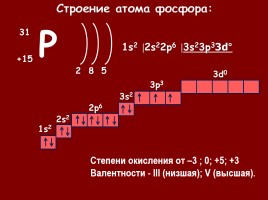
P
+15
31
2
5
8
1s2
2s2
2p6
3s2
3p3
3d0
Степени окисления от –3 ; 0; +5; +3 Валентности - III (низшая); V (высшая).
Строение атома фосфора:
1s2 |2s22p6 |3s23p33d°
+15
31
2
5
8
1s2
2s2
2p6
3s2
3p3
3d0
Степени окисления от –3 ; 0; +5; +3 Валентности - III (низшая); V (высшая).
Строение атома фосфора:
1s2 |2s22p6 |3s23p33d°
Слайд 9

8. Неметалл
9. Р2О5 – кислотный оксид
10. Н3РО4 – ортофосфорная кислота
11. РН3 – фосфороводород (фосфин)
Слайд 10

История открытия
Первым в свободном состоянии фосфор получил в 1669 гамбургский алхимик Х. Бранд. В поисках философского камня он прокалил в закрытом сосуде сухой остаток от выпаривания мочи с речным песком и древесным углем. После прокаливания сосуд c реагентами начал светиться в темноте белым светом.
Первым в свободном состоянии фосфор получил в 1669 гамбургский алхимик Х. Бранд. В поисках философского камня он прокалил в закрытом сосуде сухой остаток от выпаривания мочи с речным песком и древесным углем. После прокаливания сосуд c реагентами начал светиться в темноте белым светом.
Слайд 11

История открытия
В 1680 светящийся в темноте фосфор получил англичанин Р. Бойль. В последующие годы было установлено, что фосфор содержится не только в моче, но и в тканях головного мозга, в костях скелета. Наиболее простой метод получения фосфора прокаливанием костяной золы с углем был предложен в 1771 К. Шееле. Элементарную природу фосфора установил в конце 18 века А. Л. Лавуазье.
А.Л.Лавуазье
Р. Бойль
В 1680 светящийся в темноте фосфор получил англичанин Р. Бойль. В последующие годы было установлено, что фосфор содержится не только в моче, но и в тканях головного мозга, в костях скелета. Наиболее простой метод получения фосфора прокаливанием костяной золы с углем был предложен в 1771 К. Шееле. Элементарную природу фосфора установил в конце 18 века А. Л. Лавуазье.
А.Л.Лавуазье
Р. Бойль
Слайд 12

Слайд 13

Фосфор занимает 12-е место по распространенности элементов в природе. Он входит в состав многих горных пород и содержится в живых организмах .
Слайд 14

Слайд 15
Слайд 16

Слайд 17

Слайд 18

Слайд 19
Слайд 20

Физические свойства
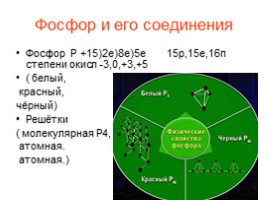
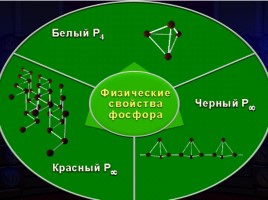
Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор имеет несколько аллотропных модификаций: белый, красный, черный.
Белый фосфор
Черный фосфор
Красный фосфор
Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор имеет несколько аллотропных модификаций: белый, красный, черный.
Белый фосфор
Черный фосфор
Красный фосфор
Слайд 21
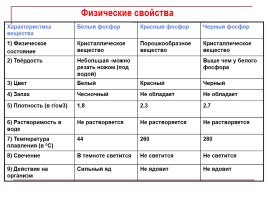
Характеристика вещества Белый фосфор Красный фосфор Черный фосфор
1) Физическое состояние Кристаллическое вещество Порошкообразное вещество Кристаллическое вещество
2) Твёрдость Небольшая -можно резать ножом (под водой) Выше чем у белого фосфора
3) Цвет Белый Красный Черный
4) Запах Чесночный Не обладает Не обладает
5) Плотность (в г/см3) 1,8 2,3 2,7
6) Растворимость в воде Не растворяется Не растворяется Не растворяется
7) Температура плавления (в 0С) 44 260 280
8) Свечение В темноте светится Не светится Не светится
9) Действие на организм Сильный яд Не ядовит Не ядовит
Физические свойства
1) Физическое состояние Кристаллическое вещество Порошкообразное вещество Кристаллическое вещество
2) Твёрдость Небольшая -можно резать ножом (под водой) Выше чем у белого фосфора
3) Цвет Белый Красный Черный
4) Запах Чесночный Не обладает Не обладает
5) Плотность (в г/см3) 1,8 2,3 2,7
6) Растворимость в воде Не растворяется Не растворяется Не растворяется
7) Температура плавления (в 0С) 44 260 280
8) Свечение В темноте светится Не светится Не светится
9) Действие на организм Сильный яд Не ядовит Не ядовит
Физические свойства
Слайд 22

АЛЛОТРОПИЯ
Белый фосфор
Красный фосфор
Черный фосфор
P(Па),t
t
P(Па)
Белый фосфор
Красный фосфор
Черный фосфор
P(Па),t
t
P(Па)
Слайд 23

Слайд 24

Белый фосфор
Белый фосфор – это яд опасный, Слегка нагреть – он вспыхнет весь, Элемент был назван «светоносным» За то, что в полной темноте Свет испускает белый фосфор, В воздушной находясь среде.
Белый фосфор – это яд опасный, Слегка нагреть – он вспыхнет весь, Элемент был назван «светоносным» За то, что в полной темноте Свет испускает белый фосфор, В воздушной находясь среде.
Слайд 25

Белый фосфор
Белый фосфор – мягкое кристаллическое вещество. Состоит из молекул P4. Плавится при температуре 44,1 С. Очень хорошо растворим в сероуглероде CS2. Легко загорается. Белый фосфор - очень неустойчивая и самая реакционноспособная аллотропная модификация.
Белый фосфор – законный военный инструмент.
Белый фосфор – мягкое кристаллическое вещество. Состоит из молекул P4. Плавится при температуре 44,1 С. Очень хорошо растворим в сероуглероде CS2. Легко загорается. Белый фосфор - очень неустойчивая и самая реакционноспособная аллотропная модификация.
Белый фосфор – законный военный инструмент.
Слайд 26

Красный фосфор
Известен людям фосфор красный, Ведь спички зажигают все. В составе смеси безопасной Он есть на каждом коробке.
Известен людям фосфор красный, Ведь спички зажигают все. В составе смеси безопасной Он есть на каждом коробке.
Слайд 27

Красный фосфор
При нагревании белого фосфора образуется красный фосфор. Он представляет собой смесь нескольких модификаций, которые имеют различную длину молекул. Цвет красного фосфора в зависимости от способа и условий получения может меняться от светло-коричневого до фиолетового и темно-коричневого. Температура плавления 585-600 С.
При нагревании белого фосфора образуется красный фосфор. Он представляет собой смесь нескольких модификаций, которые имеют различную длину молекул. Цвет красного фосфора в зависимости от способа и условий получения может меняться от светло-коричневого до фиолетового и темно-коричневого. Температура плавления 585-600 С.
Слайд 28

Слайд 29
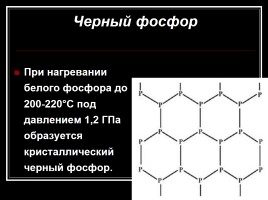
Черный фосфор
При нагревании белого фосфора до 200-220°C под давлением 1,2 ГПа образуется кристаллический черный фосфор.
При нагревании белого фосфора до 200-220°C под давлением 1,2 ГПа образуется кристаллический черный фосфор.
Слайд 30

ПОЛУЧЕНИЕ
Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора. В качестве восстановителя используют кокс (углерод). Для связывания соединений кальция добавляют кварцевый песок SiO2. Реакция протекает по уравнению: Ca3(PO4)2 +3SiО2 +5C =3CaSiO3 +2P +5CO↑
Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора. В качестве восстановителя используют кокс (углерод). Для связывания соединений кальция добавляют кварцевый песок SiO2. Реакция протекает по уравнению: Ca3(PO4)2 +3SiО2 +5C =3CaSiO3 +2P +5CO↑
Слайд 31

Химические свойства.
Взаимодействие: а) с кислородом: 4P + 5О2 = 2P2О5 б) с металлами: 3Mg + 2P = Mg3P2 фосфид магния
Взаимодействие: а) с кислородом: 4P + 5О2 = 2P2О5 б) с металлами: 3Mg + 2P = Mg3P2 фосфид магния
Слайд 32

Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH3: Mg3P2 + 6H2O = 3Mg(OH)2↓+ 2PH3↑ Фосфин PH3 по химическим свойствам похож на аммиак NH3.
Слайд 33
Слайд 34

Слайд 35
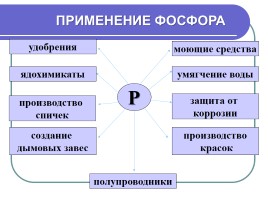
ПРИМЕНЕНИЕ ФОСФОРА
Р
удобрения
ядохимикаты
производство спичек
создание дымовых завес
полупроводники
производство красок
защита от коррозии
умягчение воды
моющие средства
Р
удобрения
ядохимикаты
производство спичек
создание дымовых завес
полупроводники
производство красок
защита от коррозии
умягчение воды
моющие средства
Слайд 36

Домашнее задание
§ 21, стр. 70 № 1 – 4; зад. № 1.
§ 21, стр. 70 № 1 – 4; зад. № 1.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.