Презентация - Азот и его соединения.
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 83%
- Слайдов: 47
- Просмотров: 4171
- Скачиваний: 1362
- Размер: 6.76 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

АЗОТ И ЕГО СОЕДИНЕНИЯ.
Слайд 2

Азот.
Порядковый номер 7. 2 период 5 группа, главная подгруппа.
Порядковый номер 7. 2 период 5 группа, главная подгруппа.
Слайд 3

Строение азота
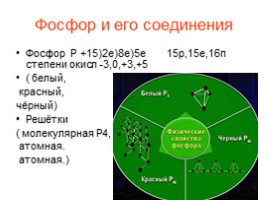
Символ: N Строение атома и молекулы азота: Элемент II периода группы VA. Заряд ядра +7, в ядре 7 протонов и 7 нейтронов. Электронная конфигурация: 1s22s22p3 Молекула состоит из двух атомов. Связь ковалентная неполярная. Электронная формула :NºN: Степени окисления: от -3 до +5 Наиболее устойчивая степень окисления 0.
Символ: N Строение атома и молекулы азота: Элемент II периода группы VA. Заряд ядра +7, в ядре 7 протонов и 7 нейтронов. Электронная конфигурация: 1s22s22p3 Молекула состоит из двух атомов. Связь ковалентная неполярная. Электронная формула :NºN: Степени окисления: от -3 до +5 Наиболее устойчивая степень окисления 0.
Слайд 4

Нахождение в природе.
В природе существуют два стабильных изотопа азота: с массовым числом 14 (99,635%) и 15 (0,365%) В основном в свободном состоянии в атмосфере – 78% по объему. Входит в состав живых организмов (белки, нуклеиновые кислоты). Небольшие количества в почве.
В природе существуют два стабильных изотопа азота: с массовым числом 14 (99,635%) и 15 (0,365%) В основном в свободном состоянии в атмосфере – 78% по объему. Входит в состав живых организмов (белки, нуклеиновые кислоты). Небольшие количества в почве.
Слайд 5
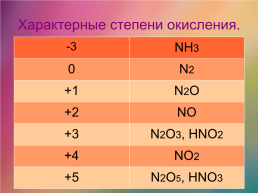
Характерные степени окисления.
-3.NH3
0.N2
+1.N2O
+2.NO
+3.N2O3, HNO2
+4.NO2
+5.N2O5, HNO3
-3.NH3
0.N2
+1.N2O
+2.NO
+3.N2O3, HNO2
+4.NO2
+5.N2O5, HNO3
Слайд 6

Физические свойства азота.
При обычных условиях газ, без цвета, запаха, вкуса. Плотность по воздуху: Dвоздух(N2) = 28/29 Растворимость в воде 23 мл/л при 0° C и 1 атм. Температура плавления –209,96 °С Температура кипения –195,8°С
При обычных условиях газ, без цвета, запаха, вкуса. Плотность по воздуху: Dвоздух(N2) = 28/29 Растворимость в воде 23 мл/л при 0° C и 1 атм. Температура плавления –209,96 °С Температура кипения –195,8°С
Слайд 7

Химические свойства N2.
Химически инертен, так как трудно разорвать тройную связь между атомами азота. 1. + кислород ( под воздействием тока) 2. + водород 3. + металлы (активные)
Химически инертен, так как трудно разорвать тройную связь между атомами азота. 1. + кислород ( под воздействием тока) 2. + водород 3. + металлы (активные)
Слайд 8

Химические свойства азота.
Очень инертен. Вступает в химические реакции в жестких условиях. 1) При обычных условиях реагирует только с литием: 6Li + N2 = 2Li3N 2) с металлами при высоких температурах: 3Ca + N2 = Ca3N2 3) с водородом при высоком давлении и температуре в присутствии катализатора (Fe): 3H2 + N2 = NH3 4) при температуре вольтовой дуги реагирует с кислородом: O2 + N2 = 2NO
Очень инертен. Вступает в химические реакции в жестких условиях. 1) При обычных условиях реагирует только с литием: 6Li + N2 = 2Li3N 2) с металлами при высоких температурах: 3Ca + N2 = Ca3N2 3) с водородом при высоком давлении и температуре в присутствии катализатора (Fe): 3H2 + N2 = NH3 4) при температуре вольтовой дуги реагирует с кислородом: O2 + N2 = 2NO
Слайд 9

Применение азота.
Слайд 10
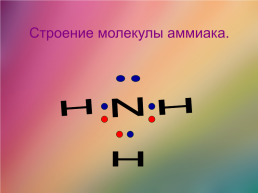
Строение молекулы аммиака.
N
H
H
H
N
H
H
H
Слайд 11

Слайд 12

Слайд 13

Получение аммиака.
В промышленности Из атмосферного азота N2 + 3H2 2NH3
В лаборатории Взаимодействием солей аммония с щелочами NH4Cl+NaOH NH3 + NaCl + H2O
В промышленности Из атмосферного азота N2 + 3H2 2NH3
В лаборатории Взаимодействием солей аммония с щелочами NH4Cl+NaOH NH3 + NaCl + H2O
Слайд 14

Химические свойства аммиака.
Проявляет основные свойства: 1. + кислота 2. каталитическое окисление (катализатор- платина) 3. неполное окисление 4. термическое разложение 5. + вода
Проявляет основные свойства: 1. + кислота 2. каталитическое окисление (катализатор- платина) 3. неполное окисление 4. термическое разложение 5. + вода
Слайд 15

Слайд 16

Слайд 17

Слайд 18

Слайд 19

Применение аммиака.
Слайд 20

Соли аммония-
Соли, в состав которых входит ион NH4+ Обладают свойством разлагаться при нагревании
Соли, в состав которых входит ион NH4+ Обладают свойством разлагаться при нагревании
Слайд 21
Слайд 22

Слайд 23

Слайд 24

Слайд 25

Слайд 26

Оксиды азота.
N2O NO N2O3 NO2 N2O5
N2O NO N2O3 NO2 N2O5
Слайд 27

Оксид азота (I) N2O.
Закись азота, «веселящий газ». Бесцветный газ со слабым запахом, растворим в воде. Безразличный (несолеобразующий) оксид. Применяется в медицине как слабое средство для наркоза, а также в пищевой промышленности.
Закись азота, «веселящий газ». Бесцветный газ со слабым запахом, растворим в воде. Безразличный (несолеобразующий) оксид. Применяется в медицине как слабое средство для наркоза, а также в пищевой промышленности.
Слайд 28

Оксид азота (II) NO.
Бесцветный газ, незначительно растворим в воде, ядовит. Безразличный (несолеобразующий) оксид. Реагирует с кислородом с образованием NO2.
Бесцветный газ, незначительно растворим в воде, ядовит. Безразличный (несолеобразующий) оксид. Реагирует с кислородом с образованием NO2.
Слайд 29

Оксид азота (III) N2O3.
Газ, очень токсичен, вызывает ожоги кожи. неустойчив при обычных условиях взаимодействует с водой, образуя азотистую кислоту HNO2. Используется для производства азотистой кислоты.
Газ, очень токсичен, вызывает ожоги кожи. неустойчив при обычных условиях взаимодействует с водой, образуя азотистую кислоту HNO2. Используется для производства азотистой кислоты.
Слайд 30

Оксид азота (IV) NO2.
Газ бурого цвета, тяжелее воздуха, ядовит. Реагирует с водой с образованием азотистой и азотной кислот. Используется для производства азотной и серной кислот
Газ бурого цвета, тяжелее воздуха, ядовит. Реагирует с водой с образованием азотистой и азотной кислот. Используется для производства азотной и серной кислот
Слайд 31

Оксиды азота.
Получается: 1) в промышленности: 2NO + O2 = 2NO2 2) в лаборатории: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O Реакции с водой: 2NO2 + H2O = HNO3 + HNO2 3NO2 + H2O = 2HNO3 + NO
молекула
Получается: 1) в промышленности: 2NO + O2 = 2NO2 2) в лаборатории: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O Реакции с водой: 2NO2 + H2O = HNO3 + HNO2 3NO2 + H2O = 2HNO3 + NO
молекула
Слайд 32

Оксиды азота.
Получение концентрированной азотной кислоты: 4NO2 + 2H2O + O2 = 4HNO3 NO2 обладает сильными окислительными свойствами: 1) SO2 + NO2 = SO3 + NO 2) 2C + 2NO2 = 2CO2 + N2 - горение
Получение концентрированной азотной кислоты: 4NO2 + 2H2O + O2 = 4HNO3 NO2 обладает сильными окислительными свойствами: 1) SO2 + NO2 = SO3 + NO 2) 2C + 2NO2 = 2CO2 + N2 - горение
Слайд 33

Фотохимический смог.
Слайд 34

«Лисий хвост»
Слайд 35

Оксид азота (V) N2O5.
Кристаллическое вещество, крайне неустойчиво, ядовито. Обладает свойствами кислотного оксида.
Кристаллическое вещество, крайне неустойчиво, ядовито. Обладает свойствами кислотного оксида.
Слайд 36

Азотистая кислота HNO2.
Очень слабая кислота, легко разлагается. Соли- нитриты.
Очень слабая кислота, легко разлагается. Соли- нитриты.
Слайд 37

Азотная кислота HNO3.
Бесцветная жидкость, при хранении приобретает желтоватый оттенок. Дымит на воздухе Гигроскопична. Смешивается с водой в любых отношениях Очень сильная кислота Реагирует с металлами после водорода При взаимодействии с металлами НИКОГДА не выделяется водород! На свету разлагается: 4HNO3(K) = 4NO2 + O2 + 2H2O
Бесцветная жидкость, при хранении приобретает желтоватый оттенок. Дымит на воздухе Гигроскопична. Смешивается с водой в любых отношениях Очень сильная кислота Реагирует с металлами после водорода При взаимодействии с металлами НИКОГДА не выделяется водород! На свету разлагается: 4HNO3(K) = 4NO2 + O2 + 2H2O
Слайд 38
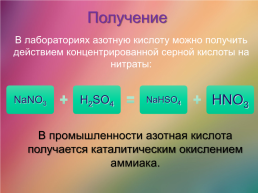
Получение
В лабораториях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
В промышленности азотная кислота получается каталитическим окислением аммиака.
В лабораториях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
В промышленности азотная кислота получается каталитическим окислением аммиака.
Слайд 39

Химические свойства
I. Разбавленная азотная кислота проявляет свойства, общие для всех кислот:
Диссоциация в водном растворе: HNO3 → H+ + NO3- Реакция с основаниями: NaOH + HNO3 = NaNO3 + H2O Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Реакция с основными оксидами: СaO + 2HNO3 = Ca(NO3)2 + H2O Реакция с солями: Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
I. Разбавленная азотная кислота проявляет свойства, общие для всех кислот:
Диссоциация в водном растворе: HNO3 → H+ + NO3- Реакция с основаниями: NaOH + HNO3 = NaNO3 + H2O Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Реакция с основными оксидами: СaO + 2HNO3 = Ca(NO3)2 + H2O Реакция с солями: Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
Слайд 40
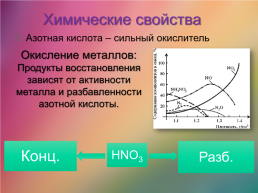
Химические свойства
II. Азотная кислота – сильный окислитель
Окисление металлов: Продукты восстановления зависят от активности металла и разбавленности азотной кислоты.
II. Азотная кислота – сильный окислитель
Окисление металлов: Продукты восстановления зависят от активности металла и разбавленности азотной кислоты.
Слайд 41

Концентрированная HNO3 + металл.
+ Au, Pt.Не реагирует
+ металлы I и II групп.МеNO3 + N2O+ H2O
+остальные металлы.MeNO3 + NO2 +H2O
+ Au, Pt.Не реагирует
+ металлы I и II групп.МеNO3 + N2O+ H2O
+остальные металлы.MeNO3 + NO2 +H2O
Слайд 42

Разбавленная HNO3 + металл
+Au, Pt.Не реагирует
+ металлы гл. п/гр I и II групп.MeNO3 +NH4NO3+H2O
Металлы до H.MeNO3+(NO/N2O/N2/NH4NO3)+H2O
Металлы после Н.MeNO3+NO+H2O
+Au, Pt.Не реагирует
+ металлы гл. п/гр I и II групп.MeNO3 +NH4NO3+H2O
Металлы до H.MeNO3+(NO/N2O/N2/NH4NO3)+H2O
Металлы после Н.MeNO3+NO+H2O
Слайд 43

Слайд 44

Нитраты – соли азотной
кислоты (cелитры)
Получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями, аммиаком и некоторыми солями.
Физические свойства. Это твердые кристаллические вещества, хорошо растворимые в воде.
Получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями, аммиаком и некоторыми солями.
Физические свойства. Это твердые кристаллические вещества, хорошо растворимые в воде.
Слайд 45

Химические свойства. Сильные электролиты, проявляют все свойства солей.
NaNO3 = Na+ + NO3-
Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3 AgNO3 + NaCl = AgCl↓ + NaNO3 Pb(NO3)2 + Zn = Pb + Zn(NO3)2 Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
NaNO3 = Na+ + NO3-
Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3 AgNO3 + NaCl = AgCl↓ + NaNO3 Pb(NO3)2 + Zn = Pb + Zn(NO3)2 Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
Слайд 46

Разложение нитратов при нагревании.
.
.
.
.
.
.
Слайд 47

^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.