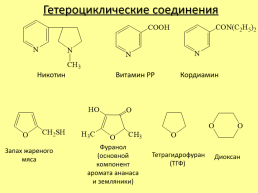
Презентация - Азотистые гетероциклические соединения
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 85%
- Слайдов: 17
- Просмотров: 2526
- Скачиваний: 653
- Размер: 0.44 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Азотистые гетероциклические соединения
Слайд 2

Пиридин С 5 H 5 N – шестичленный гетероцикл с одним атомом азота . Это бесцветная жидкость с неприятным запахом, т.кип. 115 С. Хорошо растворяется в воде и органических жидкостях. Ядовит. Пиридин
Слайд 3
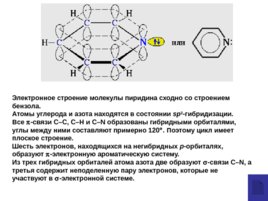
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp 2 -гибридизации. Все -связи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120 . Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р -орбиталях, образуют -электронную ароматическую систему. Из трех гибридных орбиталей атома азота две образуют -связи С–N, а третья содержит неподеленную пару электронов, которые не участвуют в -электронной системе.
Слайд 4
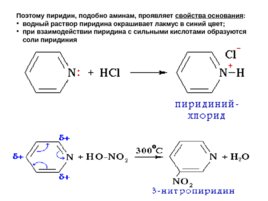
Поэтому пиридин, подобно аминам, проявляет свойства основания : водный раствор пиридина окрашивает лакмус в синий цвет; при взаимодействии пиридина с сильными кислотами образуются соли пиридиния
Слайд 5
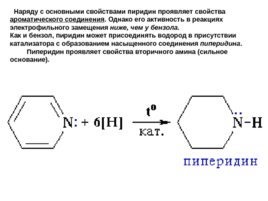
Наряду с основными свойствами пиридин проявляет свойства ароматического соединения . Однако его активность в реакциях электрофильного замещения ниже, чем у бензола . Как и бензол, пиридин может присоединять водород в присутствии катализатора с образованием насыщенного соединения пиперидина . Пиперидин проявляет свойства вторичного амина (сильное основание).
Слайд 6
Пиррол С 4 H 4 NН – пятичленный гетероцикл с одним атомом азота. Бесцветная жидкость с температурой кипения 130 С, плохо растворимая в воде, на воздухе быстро окисляется и темнеет. Пиррол
Слайд 7
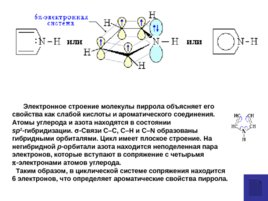
Электронное строение молекулы пиррола объясняет его свойства как слабой кислоты и ароматического соединения. Атомы углерода и азота находятся в состоянии sp 2 -гибридизации. -Связи C–C, C–H и C–N образованы гибридными орбиталями. Цикл имеет плоское строение. На негибридной р -орбитали азота находится неподеленная пара электронов, которые вступают в сопряжение с четырьмя -электронами атомов углерода. Таким образом, в циклической системе сопряжения находится 6 электронов, что определяет ароматические свойства пиррола.
Слайд 8
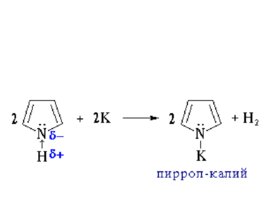
Связывание неподеленной электронной пары атома азота системой сопряжения приводит к резкому ослаблению основных и проявлению кислотных свойств. Как слабая кислота пиррол вступает в реакцию с металлическим калием, образуя соль – пиррол-калий
Слайд 9
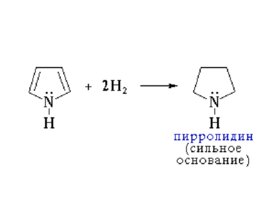
Пиррол может участвовать в реакциях присоединения: - гидрирование приводит к образованию пирролидина ; - под действием сильных минеральных кислот пиррол вступает в реакции полимеризации.
Слайд 10
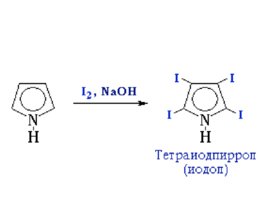
Пиррол значительно активнее бензола в реакциях электрофильного замещения, т.к. атом азота, предоставляя в систему сопряжения два электрона ( М -эффект), повышает электронную плотность в цикле. Пример - замещение 4-х атомов водорода при иодировании.
Слайд 11
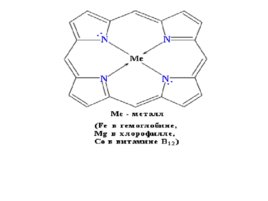
Пиррольные структуры содержатся в гемоглобине, хлорофилле, витамине В 12 и некоторых других природных соединениях. В состав молекул этих сложных веществ входит тетрапиррольный фрагмент ( порфин ) в виде комплекса с металлом.
Слайд 12

Пиримидин С 4 Н 4 N 2 - шестичленный гетероцикл с двумя атомами азота . Электроны, находящиеся на негибридных р -орбиталях, образуют 6 -электронную ароматическую систему. Проявляет свойства очень слабого основания, т.к. атомы азота в sp 2 -гибридизованном состоянии довольно прочно удерживают неподеленную электронную пару. Пиримидин
Слайд 13
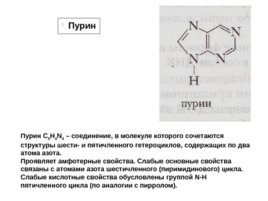
Пурин С 5 H 4 N 4 – соединение, в молекуле которого сочетаются структуры шести- и пятичленного гетероциклов, содержащих по два атома азота. Проявляет амфотерные свойства. Слабые основные свойства связаны с атомами азота шестичленного (пиримидинового) цикла. Слабые кислотные свойства обусловлены группой N-H пятичленного цикла (по аналогии с пирролом). Пурин
Слайд 14
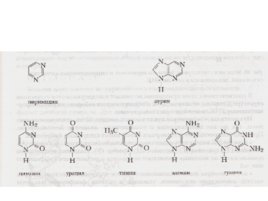
Пиримидин и пурин являются основой пиримидиновых и пуриновых оснований, входящих в состав природных высокомолекулярных веществ – нуклеиновых кислот.
Слайд 15

Пуриновые основания производные пурина, входящие в состав нуклеиновых кислот: аденин и гуанин . Для гуанина характерно динамическое равновесие между структурными изомерами, обусловленное переносом подвижного атома водорода. Образование нуклеозидов происходит, как и в случае пиримидиновых оснований, по связи N–H. Пиримидиновые основания – производные пиримидина, входящие в состав нуклеиновых кислот : урацил, тимин, цитозин. Для этих оснований, содержащих группу –ОН, характерно подвижное равновесие структурных изомеров, обусловленное переносом протона от кислорода к азоту и наоборот: урацил , тимин , цитозин .
Слайд 16
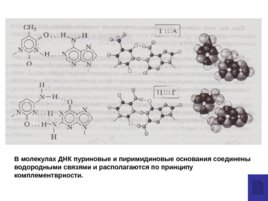
В молекулах ДНК пуриновые и пиримидиновые основания соединены водородными связями и располагаются по принципу комплементврности.
Слайд 17

Вопросы для контроля: Какие азотистые соединения называют гетероциклическими? Почему пиридин проявляет основные свойства? Приведите примеры реакций. Почему пиррол проявляет свойства слабой кислоты? Приведите примеры реакций. Какова биологическая роль пурина и пиримидина? Какие азотистые основания входят в состав нуклеиновых кислот?
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.