Презентация - Спирты
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 97%
- Слайдов: 27
- Просмотров: 3432
- Скачиваний: 1249
- Размер: 1.12 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Спирты
Слайд 2
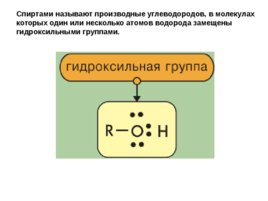
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
Слайд 3
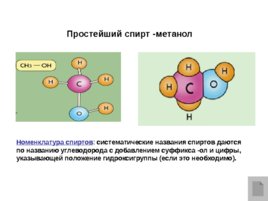
Простейший спирт -метанол Номенклатура спиртов : систематические названия спиртов даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо).
Слайд 4

Классификация спиртов 1 . По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН) и многоатомные (две и более групп -ОН). Современное название многоатомных спиртов - полиолы (диолы, триолы ит.д). Примеры: двухатомный спирт – этиленгликоль (этандиол) HO –СH 2 –CH 2 –OH трехатомный спирт – глицерин (пропантриол-1,2,3) HO–СH 2 –СН(ОН)–CH 2 –OH 2 . По строению радикалов , связанных с атомом кислорода, различают спирты: предельные , или алканолы (например, СH 3 CH 2 –OH) непредельные , или алкенолы (CH 2 CH–CH 2 –OH) ароматические (C 6 H 5 CH 2 –OH).
Слайд 5
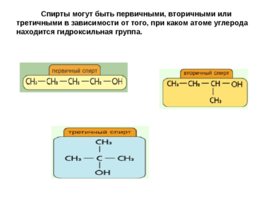
Спирты могут быть первичными, вторичными или третичными в зависимости от того, при каком атоме углерода находится гидроксильная группа.
Слайд 6

Изомерия изомерия положения ОН - группы, (начиная с С 3) ; углеродного скелета, (начиная с С 4 ); межклассовая изомерия с простыми эфирами. Например, одну и ту же молекулярную формулу С 2 H 6 O имеют: СН 3 CH 2 –OH и CH 3 –O–CH 3 этиловый спирт диметиловый эфир
Слайд 7

Физические свойства Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей R R R H O : - H O : - H O : Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (т.кип. метанола 64,5 С).
Слайд 8
Одноатомные спирты Многоатомные спирты
Слайд 9

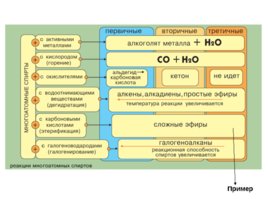
Реакции замещения водорода функциональной группы Реакции замещения функциональной группы Реакции элиминирования Реакции окисления Реакции этерификации Химические свойства спиртов
Слайд 10

Реакции замещения Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли - алкоголяты (алкоксиды): 2R–OH 2 K 2RO– K H 2 2C 2 H 5 OH 2 Na 2C 2 H 5 O– Na H 2 этилат натрия
Слайд 11
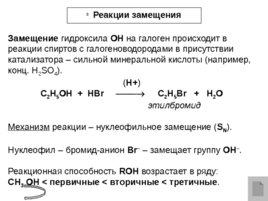
Реакции замещения Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H 2 SO 4 ). ( H ) C 2 H 5 OH H Br C 2 H 5 Br H 2 O этилбромид Механизм реакции – нуклеофильное замещение ( S N ). Нуклеофил – бромид-анион Br – – замещает группу ОН – . Реакционная способность ROH возрастает в ряду: CH 3 OH первичные вторичные третичные .
Слайд 12

Реакции дегидратации Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140 С . Например : H 2 SO 4 CH 3 CH CH 2 CH 3 CH CH 2 H 2 O t 140 C H OH H 2 SO 4 CH 3 CH CH CH 3 CH 3 CH CH CH 3 H 2 O t 140 C бутен-2 H OH Межмолекулярная дегидратация с образованием простых эфиров (при нагревании ниже 140 С): C 2 H 5 OH HOC 2 H 5 C 2 H 5 - O - C 2 H 5 H 2 O
Слайд 13
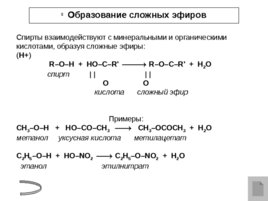
Образование сложных эфиров Спирты взаимодействуют с минеральными и органическими кислотами, образуя сложные эфиры: ( H ) R – O – H HO – C – R ' R – O – C – R ' H 2 O спирт O O кислота сложный эфир Примеры: CH 3 – O – H HO –С O – CH 3 CH 3 – O С OCH 3 H 2 O метанол уксусная кислота метилацетат C 2 H 5 – O – H HO – NO 2 C 2 H 5 – O – NO 2 H 2 O этанол этилнитрат
Слайд 14

Реакции окисления При действии окислителей ( KMn O 4 , K 2 Cr 2 O 7 H 2 SO 4 , O 2 катализатор) группа С H –О–Н превращается в карбонильную группу С О , а гидроксисоединение – в карбонильное соединение. Первичные спирты при окислении образуют альдегиды , которые затем легко окисляются до карбоновых кислот : O O R –СН 2 – OH R –СН O R –С OOH - H 2 O альдегид карбоновая кислота Например, окисление этилового спирта K 2 Cr 2 O 7 / H 2 SO 4 : 3C 2 H 5 OH 2K 2 Cr 2 O 7 8H 2 SO 4 3CH 3 COOH 2Cr 2 (SO 4 ) 3 2K 2 SO 4 11H 2 O При окислении вторичных спиртов образуются кетоны : O R CH R' R C R' - H 2 O OH O
Слайд 15

Получение спиртов Метанола Этанола Многоатомных спиртов
Слайд 16
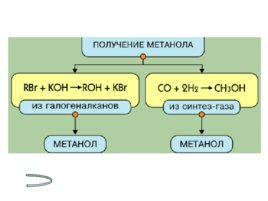
Слайд 17
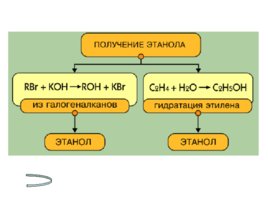
Слайд 18
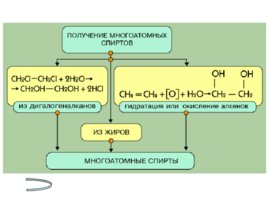
Слайд 19
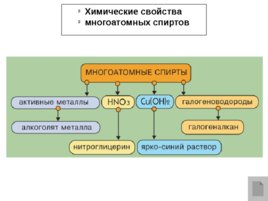
Химические свойства многоатомных спиртов
Слайд 20

Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов ( - I - эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активнымиметаллами, но и под действием их гидроксидов: HO–CH 2 CH 2 –OH 2Na OH Na O–CH 2 CH 2 –ONa 2H 2 O Многоатомные спирты с соседними ОН-группами взаимодействуют с щелочным раствором гидроксида меди (II), образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет ( качественная реакция ). Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Слайд 21
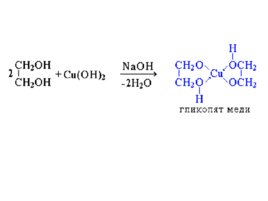
Слайд 22
Пример
Слайд 23
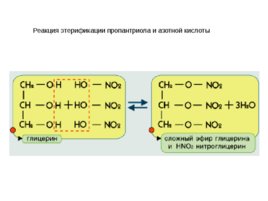
Реакция этерификации пропантриола и азотной кислоты
Слайд 24

Применение спиртов Метанол CH 3 OH -производство формальдегида, муравьиной кислоты; - растворитель. Этанол С 2 Н 5 ОН (этиловый спирт) - производство ацетальдегида, уксусной кислоты, бутадиена, простых и сложных эфиров; - растворитель для красителей, лекарственных и парфюмерных средств; - производство ликеро-водочных изделий; - дезинфицирующее средство в медицине; - горючее для двигателей, добавка к моторным топливам.
Слайд 25

Применение спиртов Этиленгликоль HOCH 2 - CH 2 OH - производство пластмасс; - компонент антифризов; - сырье в органическом синтезе. Глицерин HOCH 2 - CH ( OH )- CH 2 OH - фармацевтическая и парфюмерная промышленность; - смягчитель кожи и тканей; - производство взрывчатых веществ.
Слайд 26

Вопросы для контроля ТЕСТ Какие вещества относят к спиртам? На какие группы классифицируют спирты? Назовите виды изомерии у предельных одноатомных спиртов. Какую роль оказывают водородные связи на физические свойства спиртов? Какие химические свойства характерны для спиртов? Какова качественная реакция на многоатомные спирты? Перечислите способы получения спиртов. Назовите основные области применения спиртов.
Слайд 27

Ответы к тесту: Вопрос 1: 3 Вопрос 2: 3 Вопрос 3: 4 Вопрос 4: 2 Вопрос 5: 2
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







