Презентация - Спирты
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 92%
- Слайдов: 38
- Просмотров: 488
- Скачиваний: 26
- Размер: 2.63 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

24.12.2023
Спирты
Спирты
Слайд 2

Состав спиртов
Спирты - это органические в-ва, в молекулах которых углеводородный (алкильный) радикал связан с одной или несколькими гидроксильными группами. Гидроксильная группа – это функциональная группа. Функциональная группа - это группа атомов, которая определяет наиболее характерные свойства вещества и его принадлежность к определенному классу веществ
Спирты - это органические в-ва, в молекулах которых углеводородный (алкильный) радикал связан с одной или несколькими гидроксильными группами. Гидроксильная группа – это функциональная группа. Функциональная группа - это группа атомов, которая определяет наиболее характерные свойства вещества и его принадлежность к определенному классу веществ
Слайд 3
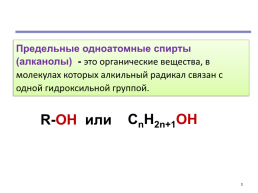
Предельные одноатомные спирты (алканолы) - это органические вещества, в молекулах которых алкильный радикал связан с одной гидроксильной группой.
CnH2n+1OH
R-OH или
Слайд 4
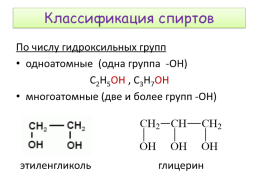
Классификация спиртов
По числу гидроксильных групп одноатомные (одна группа -ОН) С2Н5ОН , С3Н7ОН многоатомные (две и более групп -ОН)
этиленгликоль
глицерин
По числу гидроксильных групп одноатомные (одна группа -ОН) С2Н5ОН , С3Н7ОН многоатомные (две и более групп -ОН)
этиленгликоль
глицерин
Слайд 5

но!
Спирты с двумя ОН-группами при одном и том же атоме углерода неустойчивы и , отщепляя воду, сразу превращаются в альдегиды.
С тремя ОН-группами при одном и том же атоме углерода не существуют
Слайд 6
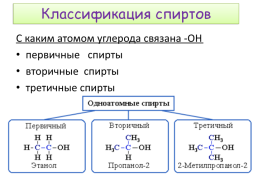
Классификация спиртов
С каким атомом углерода связана -ОН первичные спирты вторичные спирты третичные спирты
С каким атомом углерода связана -ОН первичные спирты вторичные спирты третичные спирты
Слайд 7

Классификация спиртов
По строению радикалов предельные: CH3CH2CH2—OH непредельные: CH2=CH—CH2OH ароматические: C6H5—CH2—OH
По строению радикалов предельные: CH3CH2CH2—OH непредельные: CH2=CH—CH2OH ароматические: C6H5—CH2—OH
Слайд 8

Но!
CH2=CH-OH
неустойчивы
легко превращаются в альдегиды или кетоны
Слайд 9
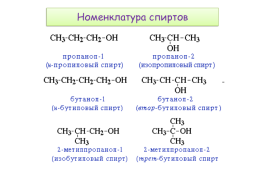
Номенклатура спиртов
Слайд 10
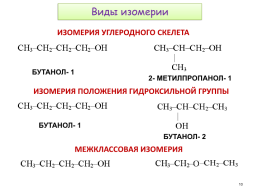
Виды изомерии
ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА
БУТАНОЛ- 1
2- МЕТИЛПРОПАНОЛ- 1
ИЗОМЕРИЯ ПОЛОЖЕНИЯ ГИДРОКСИЛЬНОЙ ГРУППЫ
БУТАНОЛ- 1
БУТАНОЛ- 2
МЕЖКЛАССОВАЯ ИЗОМЕРИЯ
ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА
БУТАНОЛ- 1
2- МЕТИЛПРОПАНОЛ- 1
ИЗОМЕРИЯ ПОЛОЖЕНИЯ ГИДРОКСИЛЬНОЙ ГРУППЫ
БУТАНОЛ- 1
БУТАНОЛ- 2
МЕЖКЛАССОВАЯ ИЗОМЕРИЯ
Слайд 11
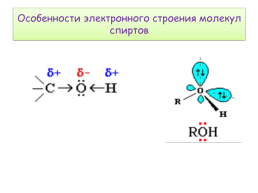
Особенности электронного строения молекул спиртов
Слайд 12
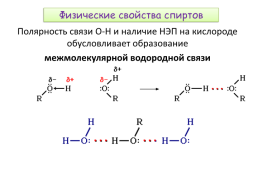
Физические свойства спиртов
Полярность связи О-Н и наличие НЭП на кислороде обусловливает образование межмолекулярной водородной связи
Полярность связи О-Н и наличие НЭП на кислороде обусловливает образование межмолекулярной водородной связи
Слайд 13
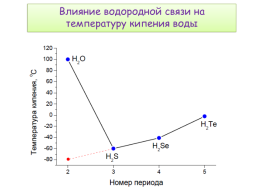
Влияние водородной связи на температуру кипения воды
Слайд 14
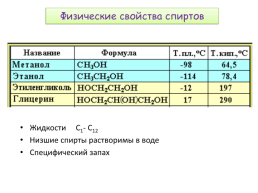
Физические свойства спиртов
Жидкости С1- С12 Низшие спирты растворимы в воде Специфический запах
Жидкости С1- С12 Низшие спирты растворимы в воде Специфический запах
Слайд 15
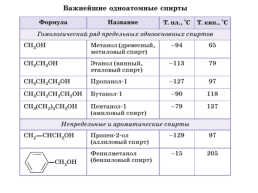
Слайд 16
24.12.2023
Химические свойства спиртов
Химические свойства спиртов
Слайд 17
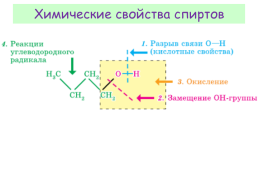
Химические свойства спиртов
Слайд 18
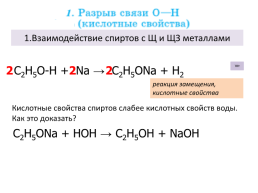
1.Взаимодействие спиртов с Щ и ЩЗ металлами
С2Н5О-Н + Na → C2H5ONa + H2
реакция замещения, кислотные свойства
Кислотные свойства спиртов слабее кислотных свойств воды. Как это доказать?
C2H5ONa + HОH →
С2Н5ОН + NaOH
Слайд 19

2. Алкилирование спиртов (р.Вильямсона)
СН3О-Na + CH3 -I →
CH3 -O-CH3 + NaI
класс: простые эфиры
диметиловый эфир
СН3О-Na + CH3 -I →
CH3 -O-CH3 + NaI
класс: простые эфиры
диметиловый эфир
Слайд 20
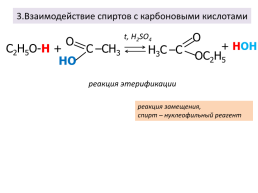
3.Взаимодействие спиртов с карбоновыми кислотами
t, H2SO4
+ НОН
С2Н5О-Н +
реакция этерификации
реакция замещения, спирт – нуклеофильный реагент
t, H2SO4
+ НОН
С2Н5О-Н +
реакция этерификации
реакция замещения, спирт – нуклеофильный реагент
Слайд 21
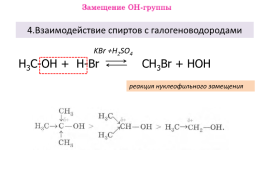
4.Взаимодействие спиртов с галогеноводородами
KBr +H2SO4
Н3С-ОН + H-Br
CH3Br + HOH
реакция нуклеофильного замещения
Слайд 22
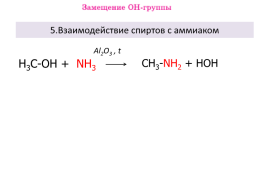
5.Взаимодействие спиртов с аммиаком
Al2O3 , t
Н3С-ОН + NH3
CH3-NH2 + HOH
Слайд 23
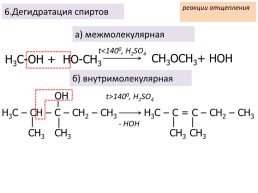
реакции отщепления
6.Дегидратация спиртов
а) межмолекулярная
t<1400, H2SO4
CH3OCH3+ HOH
Н3С-ОН + HO-CH3
б) внутримолекулярная
t>1400, H2SO4
- HOH
6.Дегидратация спиртов
а) межмолекулярная
t<1400, H2SO4
CH3OCH3+ HOH
Н3С-ОН + HO-CH3
б) внутримолекулярная
t>1400, H2SO4
- HOH
Слайд 24
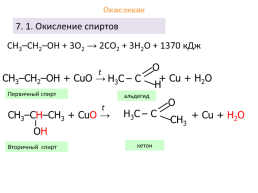
7. 1. Окисление спиртов
СН3–СН2–ОН + 3О2 → 2СO2 + 3H2O + 1370 кДж
t
СН3–СН2–ОН + СuО → + Сu + H2O
Первичный спирт
альдегид
t
СН3–СН–CН3 + СuО → + Сu + H2O
кетон
Вторичный спирт
Слайд 25
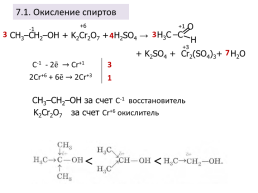
7.1. Окисление спиртов
+6
+1
-1
СН3–СН2–ОН + K2Cr2O7 + H2SO4 →
+3
+ K2SO4 + Cr2(SO4)3+ H2O
C-1 - 2ē → Cr+1
2Cr+6 + 6ē → 2Cr+3
СН3–СН2–ОН за счет C-1 восстановитель
K2Cr2O7 за счет Cr+6 окислитель
+6
+1
-1
СН3–СН2–ОН + K2Cr2O7 + H2SO4 →
+3
+ K2SO4 + Cr2(SO4)3+ H2O
C-1 - 2ē → Cr+1
2Cr+6 + 6ē → 2Cr+3
СН3–СН2–ОН за счет C-1 восстановитель
K2Cr2O7 за счет Cr+6 окислитель
Слайд 26
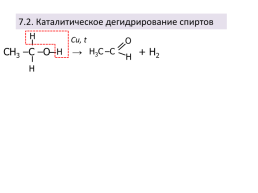
7.2. Каталитическое дегидрирование спиртов
Сu, t
СН3 –С –О → + H2
Н
Сu, t
СН3 –С –О → + H2
Н
Слайд 27
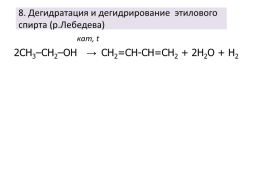
8. Дегидратация и дегидрирование этилового спирта (р.Лебедева)
кат, t
2СН3–СH2–ОH →
CH2=CH-CH=CH2 + 2H2O + H2
кат, t
2СН3–СH2–ОH →
CH2=CH-CH=CH2 + 2H2O + H2
Слайд 28
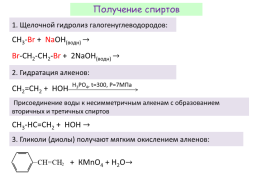
Получение спиртов
1. Щелочной гидролиз галогенуглеводородов:
СН3-Br + NaOH(водн) →
Вr-СН2-CH2-Br + 2NaOH(водн) →
2. Гидратация алкенов:
H3PO4, t=300, P=7МПа
СН2=СН2 + НOH
Присоединение воды к несимметричным алкенам с образованием вторичных и третичных спиртов
СH3-HС=СН2 + НOH →
3. Гликоли (диолы) получают мягким окислением алкенов:
+ КMnO4 + H2O→
1. Щелочной гидролиз галогенуглеводородов:
СН3-Br + NaOH(водн) →
Вr-СН2-CH2-Br + 2NaOH(водн) →
2. Гидратация алкенов:
H3PO4, t=300, P=7МПа
СН2=СН2 + НOH
Присоединение воды к несимметричным алкенам с образованием вторичных и третичных спиртов
СH3-HС=СН2 + НOH →
3. Гликоли (диолы) получают мягким окислением алкенов:
+ КMnO4 + H2O→
Слайд 29

Получение спиртов
4. Получение метанола из синтез-газа:
Cr2O3, ZnO, t, P
СО + 2Н2
5. Получение этанола брожением глюкозы:
ферменты
С6Н12O6
4. Получение метанола из синтез-газа:
Cr2O3, ZnO, t, P
СО + 2Н2
5. Получение этанола брожением глюкозы:
ферменты
С6Н12O6
Слайд 30
24.12.2023
Многоатомные спирты
Многоатомные спирты
Слайд 31
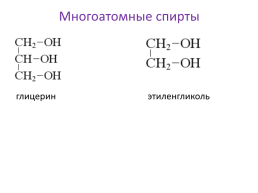
Многоатомные спирты
глицерин
этиленгликоль
глицерин
этиленгликоль
Слайд 32

1.Взаимодействие с Щ и ЩЗ металлами
2.Взаимодействие с галогеноводородами
2.Взаимодействие с галогеноводородами
Слайд 33

3. Дегидратация
а) межмолекулярная
б) внутримолекулярная
а) межмолекулярная
б) внутримолекулярная
Слайд 34

3. Окисление
а) дегидрирование
б) окисление оксидом меди (II), кислородом (кат-кое)
а) дегидрирование
б) окисление оксидом меди (II), кислородом (кат-кое)
Слайд 35
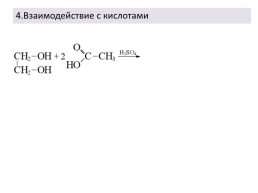
4.Взаимодействие с кислотами
Слайд 36
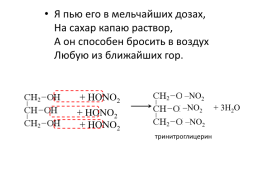
Я пью его в мельчайших дозах, На сахар капаю раствор, А он способен бросить в воздух Любую из ближайших гор.
–NO2
–NO2
+ HONO2
–NO2
+ 3H2O
+ HONO2
–NO2
+ HONO2
тринитроглицерин
–NO2
–NO2
+ HONO2
–NO2
+ 3H2O
+ HONO2
–NO2
+ HONO2
тринитроглицерин
Слайд 37
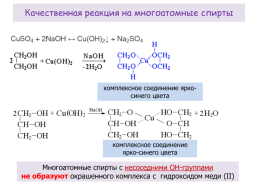
Качественная реакция на многоатомные спирты
комплексное соединение ярко-синего цвета
комплексное соединение ярко-синего цвета
Многоатомные спирты с несоседними ОН-группами не образуют окрашенного комплекса с гидроксидом меди (II)
комплексное соединение ярко-синего цвета
комплексное соединение ярко-синего цвета
Многоатомные спирты с несоседними ОН-группами не образуют окрашенного комплекса с гидроксидом меди (II)
Слайд 38

^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







