Презентация - Классификация химических реакций
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 95%
- Слайдов: 37
- Просмотров: 5461
- Скачиваний: 2326
- Размер: 4.04 MB
- Класс: 8
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Слайд 2

«Классификация химических реакций
8 класс
8 класс
Слайд 3

На уроке мы повторим и закрепим:
-классификацию веществ,
-типы химических реакций, и признаки их классификации
Применять полученные знания о о типах химических реакций на практике
– составлять уравнения химических реакций,
– расставлять коэффициенты,
–определять типы химических
реакций
– решать задачи по уравнениям
химических реакций
Слайд 4
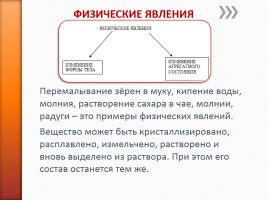
ФИЗИЧЕСКИЕ ЯВЛЕНИЯ
Перемалывание зёрен в муку, кипение воды, молния, растворение сахара в чае, молнии, радуги – это примеры физических явлений.
Вещество может быть кристаллизировано, расплавлено, измельчено, растворено и вновь выделено из раствора. При этом его состав останется тем же.
Перемалывание зёрен в муку, кипение воды, молния, растворение сахара в чае, молнии, радуги – это примеры физических явлений.
Вещество может быть кристаллизировано, расплавлено, измельчено, растворено и вновь выделено из раствора. При этом его состав останется тем же.
Слайд 5

Изменение окраски
Появление запаха
Образование осадка (растворение)
Выделение газа
Выделение тепла и света
Появление запаха
Образование осадка (растворение)
Выделение газа
Выделение тепла и света
Слайд 6

1. Экзотермические реакции протекают с выделением энергии:
Классификация химических реакций
4P + 5O2 = 2P2O5 + Q кДж
2. Эндотермические реакции протекают с поглощением энергии:
2HgO = 2Hg↓ + O2↑ - Q кДж
Классификация химических реакций
4P + 5O2 = 2P2O5 + Q кДж
2. Эндотермические реакции протекают с поглощением энергии:
2HgO = 2Hg↓ + O2↑ - Q кДж
Слайд 7

С + O2 = СO2
СO2 +Н2О = Н2СО3
– реакции, при которых из двух и более веществ образуется одно сложное вещество.
Реакции соединения
– реакции, при которых из двух и более веществ образуется одно сложное вещество.
Реакции соединения
Слайд 8

– это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
2HgO = 2Hg + O2
2KNO3 = 2KNO2 + O2
Реакции разложения
2HgO = 2Hg + O2
2KNO3 = 2KNO2 + O2
Реакции разложения
Слайд 9

– это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
Zn + 2HCl = ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
Реакции замещения
Zn + 2HCl = ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
Реакции замещения
Слайд 10

– это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
NaOH + HNO3 = NaNO3 + H2O
Реакции обмена
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
NaOH + HNO3 = NaNO3 + H2O
Реакции обмена
Слайд 11
АВ+CD=AD+BC
Слайд 12

1.Реакции, протекающие с поглощением теплоты, называются:
А) эндотермическими;
Б) термическими;
В) экзотермическими.
2. Из нескольких простых или сложных веществ образуется одно более сложное
вещество в реакции:
А) замещения;
Б) соединения;
В) разложения.
3. Уравнение реакции обмена:
А) CaO + SiO2= CaSiO3;
Б) 2 KClO3= 2KCl+3O2;
В) FeS+2HCl=FeCl2+H2S;
ТЕСТ
ТЕСТ
Слайд 13

4.Реакции, протекающие с выделением теплоты, называются:
А) экзотермическими;
Б) термическими;
В) эндотермическими;
5. Уравнение реакции разложения:
А) CaO + SiO2= CaSiO3;
Б) 2 KClO3= 2KCl+3O2;
В) FeS+2HCl=FeCl2+H2S
Слайд 14

Проверим
1 - 2 - 3 - 4 - 5 -
А) эндотермическими;
Б) соединения;
В) FeS+2HCl=FeCl2+H2S;
А) экзотермическими;
Б) 2 KClO3= 2KCl+3O2;
1 - 2 - 3 - 4 - 5 -
А) эндотермическими;
Б) соединения;
В) FeS+2HCl=FeCl2+H2S;
А) экзотермическими;
Б) 2 KClO3= 2KCl+3O2;
Слайд 15

Химическая железная дорога.
Запишите формулы веществ в соответствующие столбцы таблицы N2O5, Са, HNO3, Ca(OH)2, Na2O, Fe, H2SO4, H3PO4 ,N2, Na2SiO3, Н2, LiOH, Cu.
Простые вещества Простые вещества Сложные вещества Сложные вещества Сложные вещества Сложные вещества
Металлы Неметаллы Окси ды Основа ния Кис лоты Соли
Запишите формулы веществ в соответствующие столбцы таблицы N2O5, Са, HNO3, Ca(OH)2, Na2O, Fe, H2SO4, H3PO4 ,N2, Na2SiO3, Н2, LiOH, Cu.
Простые вещества Простые вещества Сложные вещества Сложные вещества Сложные вещества Сложные вещества
Металлы Неметаллы Окси ды Основа ния Кис лоты Соли
Слайд 16

Правильный ответ.
Простые вещества Простые вещества Сложные вещества Сложные вещества Сложные вещества Сложные вещества
Метал лы Cu, Fe Неметал лы I2, N2 Окси ды N2O5, Na2O Основа ния Ca(OH)2, Li OH Кис лоты HNO3 H2SO4 H3PO4 Соли Na2SiO3
Простые вещества Простые вещества Сложные вещества Сложные вещества Сложные вещества Сложные вещества
Метал лы Cu, Fe Неметал лы I2, N2 Окси ды N2O5, Na2O Основа ния Ca(OH)2, Li OH Кис лоты HNO3 H2SO4 H3PO4 Соли Na2SiO3
Слайд 17

ПОДНЯТИЕ В ГОРУ
Слайд 18

«Наскальные рисунки».
+Q
+
=
+
=
- Q
+
=
+
+
=
+
2)
3)
4)
1)
+Q
+
=
+
=
- Q
+
=
+
+
=
+
2)
3)
4)
1)
Слайд 19

1.Реакция соединения, экзотермическая.
2.Реакция разложения, эндотермическая.
3.Реакция замещения.
4.Реакция обмена
«Наскальные рисунки». Правильный ответ
«Наскальные рисунки». Правильный ответ
Слайд 20

Слайд 21

Составьте уравнения реакций, используя подходящие реактивы:
NaOH
a)Ba BaO Ba(OH)2 BaSO4
Н2О
BaСl2
NaOH
a)Ba BaO Ba(OH)2 BaSO4
Н2О
BaСl2
Слайд 22

Привал
Слайд 23

Задание игры «Крестики-нолики».
Необходимо найти выигрышный путь, состоящий из уравнений реакций замещения
Cl2 + 2KI = 2KCl + I2 4NO2 + 2H2O + O2 = 4HNO3 4AgNO3 = 2Ag2O + 4NO2 + O2
Cu(OH)2 =CuO + H2O Na2SO4 + BaCl2 = BaSO4 + 2NaCl 2Zn + O2 = 2ZnO
2Al + 6HCl = 2AlCl3 + 3H2 Fe2O3 + 3H2 = 3H2O + 2Fe 2HCl + Zn = ZnCl2 + H2
Cl2 + 2KI = 2KCl + I2 4NO2 + 2H2O + O2 = 4HNO3 4AgNO3 = 2Ag2O + 4NO2 + O2
Cu(OH)2 =CuO + H2O Na2SO4 + BaCl2 = BaSO4 + 2NaCl 2Zn + O2 = 2ZnO
2Al + 6HCl = 2AlCl3 + 3H2 Fe2O3 + 3H2 = 3H2O + 2Fe 2HCl + Zn = ZnCl2 + H2
Слайд 24

Царь зовет к себе Стрельца – удалого молодца,
И дает ему поручение государственного значения: «Чтоб я стал опять богат, нужен мне алюминия сульфат. Ночь даю тебе подумать, утром буду ждать доклад. Не смогешь – кого винить? Должен я тебя казнить. Запиши себе названье, чтоб со страху не забыть».
Напишите в тетради формулу уравнения
реакции взаимодействия сульфата
алюминия с гидроксидом калия
Укажите тип реакции.
Al2 (SO4 )3
Al2 (SO4 )3
Слайд 25

Задание «Стрельба глазами».
1. В периодической системе найдите самый активный элемент-неметалл.
2. Переведите свой взгляд влево, на элемент, стоящий в том же периоде в III группе.
3. Переведите взгляд вниз и влево, на самый активный металл.
4. Переведите взгляд вверх и вправо, на элемент, атомы которого образуют вещество, поддерживающее горение.
5. Переведите взгляд вниз и влево, на элемент, атомы которого образуют металл, используемый в градусниках.
6. Переведите взгляд вверх и вправо, на элемент с относительной атомной массой 35,5.
Слайд 26

1) P+O2=…. 2)Al+…=Al2(SO4)3+H2 3)… +Cl2=AlCl3 4)Fe+…=FeCl3 5) H2+O2=….
Водопад реакций.
Слайд 27

Водопад реакций.
1) 4P+5O2 = 2P2O5 2)2Al+3H2SO4 = Al2(SO4)3+3H2 3)2Al +3Cl2 = 2AlCl3 4)2Fe+3Cl2 = 2FeCl3 5) 2H2+O2 = 2H2O
Правильный ответ
1) 4P+5O2 = 2P2O5 2)2Al+3H2SO4 = Al2(SO4)3+3H2 3)2Al +3Cl2 = 2AlCl3 4)2Fe+3Cl2 = 2FeCl3 5) 2H2+O2 = 2H2O
Правильный ответ
Слайд 28

Составьте уравнения реакций,
назовите продукты реакций
И определите тип
1вариант
1)NaOH+CuCl2 =
2)SO3+H2O=
3)HCl+Na=
2 вариант
1) CuSO4+KOH=
2) C+O2=
3) CuCl2 + Zn =
Река уравнений реакций
Река уравнений реакций
Слайд 29

Правильный ответ.
1) 2NaOH+CuCl2=Cu(OH)2+2NaCl 2) SO3+H2O=H2SO4 3) 2HCl+2Na=2NaCl+H2 2 вариант 1) CuSO4+2KOH=Cu(OH)2+K2SO4 C+O2=CO2 3) CuCl2 + Zn = ZnCl2 +Cu
Река уравнений
1 вариант
Слайд 30
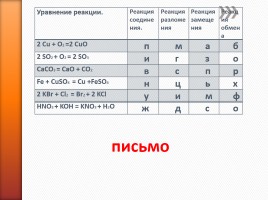
Уравнение реакции. Реакция соединения. Реакция разложения Реакция замещения Реакция обмена
2 Cu + O2 =2 CuO п м а б
2 SO2 + O2 = 2 SO3 и г з о
CaCO3 = CaO + CO2 в с п р
Fe + CuSO4 = Cu +FeSO4 н ц ь х
2 KBr + Cl2 = Br2 + 2 KCl у и м ф
HNO3 + KOH = KNO3 + H2O ж д с о
письмо
2 Cu + O2 =2 CuO п м а б
2 SO2 + O2 = 2 SO3 и г з о
CaCO3 = CaO + CO2 в с п р
Fe + CuSO4 = Cu +FeSO4 н ц ь х
2 KBr + Cl2 = Br2 + 2 KCl у и м ф
HNO3 + KOH = KNO3 + H2O ж д с о
письмо
Слайд 31

Реактивы растворы : серной кислоты, карбоната натрия, хлорида магния, гидроксида натрия.
Слайд 32

1. Вычислите массу алюминия, необходимого для реакции с кислородом объемом 11,2 л Схема реакции:
4Al + 3O2 → 2Al2O3
РЕШИТЕ ЗАДАЧИ
2. Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуется сульфат калия и вода.
РЕШИТЕ ЗАДАЧИ
2. Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуется сульфат калия и вода.
Слайд 33

ДОРОГА ДОМОЙ
Уравнение реакции Тип химической реакции
а) Al + O2 —> Al2O3 Реакция……………..
б) MnO2 + H2 —> Mn + H2O Реакция……………..
в) H2O2 —> H2 + O2 Реакция……………..
г) HNO3 + Fe(OH)3 —> Fe(NO3)3 + H2O Реакция……………..
Задание на «3». Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакций . Таблица 1
Д/З
Каждый выбирает себе задание на ту оценку, которая его устраивает.
Уравнение реакции Тип химической реакции
а) Al + O2 —> Al2O3 Реакция……………..
б) MnO2 + H2 —> Mn + H2O Реакция……………..
в) H2O2 —> H2 + O2 Реакция……………..
г) HNO3 + Fe(OH)3 —> Fe(NO3)3 + H2O Реакция……………..
Задание на «3». Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакций . Таблица 1
Д/З
Каждый выбирает себе задание на ту оценку, которая его устраивает.
Слайд 34
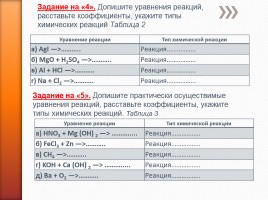
Уравнение реакции Тип химической реакции
а) AgI —>……….. Реакция……………..
б) MgO + H2SO4 —>……….. Реакция……………..
в) Al + HCl —>……….. Реакция……………..
г) Na + Cl2 —>……….. Реакция……………..
Уравнение реакции Тип химической реакции
а) HNO3 + Mg (OH) 2 —> ………..... Реакция……………..
б) FeCl3 + Zn —>……….. Реакция……………..
в) CH4 —>……….. Реакция……………..
г) KOH + Ca (OH) 2 —> ………..... Реакция……………..
д) Ba + O2 —>……….. Реакция……………..
Задание на «4». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций Таблица 2
Задание на «5». Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций. Таблица 3
а) AgI —>……….. Реакция……………..
б) MgO + H2SO4 —>……….. Реакция……………..
в) Al + HCl —>……….. Реакция……………..
г) Na + Cl2 —>……….. Реакция……………..
Уравнение реакции Тип химической реакции
а) HNO3 + Mg (OH) 2 —> ………..... Реакция……………..
б) FeCl3 + Zn —>……….. Реакция……………..
в) CH4 —>……….. Реакция……………..
г) KOH + Ca (OH) 2 —> ………..... Реакция……………..
д) Ba + O2 —>……….. Реакция……………..
Задание на «4». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций Таблица 2
Задание на «5». Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций. Таблица 3
Слайд 35

Дополнительное задание
Слайд 36

Если хочешь ты учиться, Запомни раз и навсегда: Не стоит слишком торопиться.
Ты слушай, все запоминай,
Ответы верные давай,
Всегда ты думай головой,
И знания будут тогда с тобой!!! И помни – химия всегда вокруг,
Она - твой верный друг,
А знания тебе удачу принесут.
В Ы В О Д:
В Ы В О Д:
Слайд 37

Спасибо за работу!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







