Презентация - Общие свойства металлов
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 97%
- Слайдов: 43
- Просмотров: 6154
- Скачиваний: 2706
- Размер: 2.61 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Общие химические свойства металлов
Общие химические свойства металлов Биология - наука о жвом мире - Общие свойства живых организмов
Биология - наука о жвом мире - Общие свойства живых организмов Химические свойства металлов - Электрохимический ряд напряжения металлов
Химические свойства металлов - Электрохимический ряд напряжения металлов Химические свойства металлов
Химические свойства металлов Свойства черных и цветных металлов
Свойства черных и цветных металлов Химические свойства металлов
Химические свойства металлов Общие свойства живого
Общие свойства живого
Слайды и текст этой онлайн презентации
Слайд 1

Общие свойства металлов
Слайд 2

Из 118 известных к настоящему времени элементов только 24 относятся к неметаллам, большинство же элементов – металлы. К металлам относят все s -, d -, f -элементы, а также p -элементы, условно располагающиеся в нижней части периодической системы от диагонали, проведенной от бора к астату.
Слайд 3

Металлы это элементы, между атомами которых осуществляется металлическая связь. Это сильно нелокализованная связь, когда свободные электроны (электронный газ) связывают положительные ионы металла, находящиеся в узлах кристаллической решетки. Для осуществления металлической связи необходимо, чтобы атомы имели свободные орбитали на валентном уровне.
Слайд 4

признаки металлов Твердость Пластичность Блеск Электро- и теплопроводность
Слайд 5

Классификация металлов В технике основана на различии физических свойств По величине плотности их делят на легкие (ρ 5 г/см 3 ) и тяжелые (ρ 5 г/см 3 ). Самым легким считается Литий (ρ 0,53 г/см 3 ), максимальную плотность имеет осмий (ρ 22,5 г/см 3 ).
Слайд 6

По температурам плавления, периодически изменяющимся с ростом порядкового номера элемента, различают легкоплавкие металлы, с температурой плавления ниже 1000 С , и тугоплавкие – выше 1500 С. Классификация металлов Минимальную температуру плавления имеет ртуть (-38,89 С), максимальную – вольфрам (3410 С).
Слайд 7

Классификация металлов Металлы отличаются также своим отношением к магнитным полям. По этому свойству они делятся на три группы: ферромагнитные металлы – способные намагничиваться при действии слабых магнитных полей (железо, кобальт, никель, гадолиний); парамагнитные металлы – проявляющие слабую способность к намагничиванию (алюминий, хром, титан и большая часть лантаноидов); диамагнитные металлы – не притягивающиеся к магниту и даже слегка отталкивающиеся от него (висмут, олово, медь).
Слайд 8

В практике имеет место исторически сложившееся деление металлов на черные и цветные . Классификация металлов Все остальные металлы объединяют в группу цветных. К черным принято относить железо, сплавы на его основе и металлы, которые применяются в этих сплавах (Mn, Cr).
Слайд 9

под металлами принято понимать элементы, атомы которых благодаря низким ионизационным потенциалам склонны к отдаче электронов и образованию положительных ионов: Na – ē Na Ba – 2 ē Ba 2 С электрохимической точки зрения На основании структуры электронной оболочки атомов к металлам относят s-элементы (кроме водорода и гелия); p - элементы ( Al, Ga, In, Tl, Sn, Pb, Bi ) ; d - и f - элементы.
Слайд 10

Слайд 11
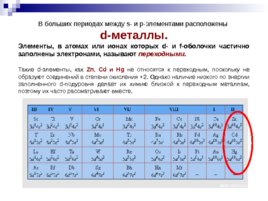
В больших периодах между s- и p-элементами расположены d-металлы. Элементы, в атомах или ионах которых d- и f-оболочки частично заполнены электронами, называют переходными. Такие d-элементы, как Zn, Cd и Hg не относятся к переходным, поскольку не образуют соединений в степени окисления 2. Однако наличие низкого по энергии заполненного d-подуровня делает их химию близкой к переходным металлам, поэтому их часто рассматривают вместе.
Слайд 12
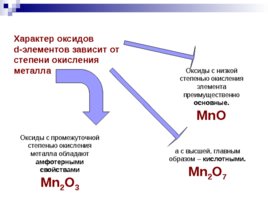
Характер оксидов d-элементов зависит от степени окисления металла Оксиды с низкой степенью окисления элемента преимущественно основные. Mn O Оксиды с промежуточной степенью окисления металла обладают амфотерными свойствами Mn 2 O 3 а с высшей, главным образом – кислотными. Mn 2 O 7
Слайд 13

К f-металлам относятся лантаноиды и актиноиды. У первых заполняется 4f-подуровень , у вторых – 5f-подуровень. Основная их степень окисления ( 3), но для многих из них известны и более высокие ее значения (Ce O 2 , UO 3 ). При повышении степени окисления металла свойства оксидов изменяются от основных к амфотерным и далее к кислотным.
Слайд 14

Атомы металлов кристаллизуются лишь в трех структурах с плотней- шей упаковкой частиц: 1) объемноцентрированной кубической (кч 8) – Li, Na, K, Rb, Cs, Ba; 2) гранецентрированной кубической (кч 12) – Ca, Sr, Cu, Ag. Au и др . ; 3) гексоганальной (кч 12) – Be, Mg, Ca, Os и др . Кристаллическая решетка В кристаллической решетке можно выделить наименьший параллелепипед, перемещением которого во всех трех измерениях получается кристалл. Такая структурная единица называется элементарной ячейкой. Элементарные кристаллические решетки металлов а) – кубическая объемноцентрированная; б) – кубическая гранецентрированная; в) – гексагональная
Слайд 15

Металлы в природе Самый распространенный металл на Земле – алюминий (более 8% земной коры)
Слайд 16

Состав руд чрезвычайно разнообразен, часто металлы представлены в них в виде оксидных или сульфидных минералов. Оксидные минералы гематит Fe 2 O 3 боксит Al 2 O 3 n H 2 O куприт Cu 2 O
Слайд 17

пиролюзит Mn O 2 касситерит Sn O 2
Слайд 18

Сульфидные минералы гaленит Pb S арсенопирит Fe As S
Слайд 19

халькопирит Сu Fe S 2 пирит Fe S 2 молибденит Mo S 2
Слайд 20

Силикаты и алюмосиликаты: Zr Si O 4 – циркон; 3Be O Al 2 O 3 6Si O 2 –берилл; Na 2 O (K 2 O) Al 2 O 3 2Si O 2 – нефелин. Минералы-соли Карбонаты: Ca CO 3 – кальцит (мел, мрамор, известняк); Sr CO 3 – стронцианит; Ca CO 3 Mg CO 3 - доломит. Сульфаты: Ba SO 4 – барит; Ca SO 4 2H 2 O – гипс; Na 2 SO 4 10H 2 O – мирабилит; Галиды: KCl – сильвин; Na Cl KCl – сильвинит; KCl Mg Cl 2 H 2 O – карналлит; 3Na F Al F 3 – криолит; Полиметаллические руды: Fe Ti O 3 – ильменит (титанат); Ca WO 4 – шеелит (вольфрамат); Pb Cr O 4 – кроксит (хромат) и др. Некоторые металлы не образуют рудных залежей. Их принято называть рассеянными – Ga, In, Tl и др.
Слайд 21

Получением металлов занимается металлургия – одна из наиболее древних отраслей химической технологии.
Слайд 22

Слайд 23

Пирометаллургия Пирометаллургическими считаются методы высокотемпературного извлечения металлов из различных соединений. Чаще всего это процессы восстановления: более активными металлами Al, Mg, Ca, Na и др. (металлотермия), кремнием (силикатотермия), водородом, гидридами металлов и т. д.
Слайд 24

Сульфидные руды подвергают окислительному обжигу, а карбонатные – прокаливанию. Полученные оксиды затем восстанавливают: 2Pb S 3O 2 2Pb O 2SO 2 ; Pb O CO Pb CO 2 ; Zn CO 3 Zn O CO 2 ; 2Zn O C 2Zn CO 2 Например,
Слайд 25
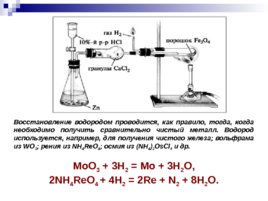
Восстановление водородом проводится, как правило, тогда, когда необходимо получить сравнительно чистый металл. Водород используется, например, для получения чистого железа; вольфрама из WO 3 ; рения из NH 4 Re O 4 ; осмия из (NH 4 ) 2 Os Cl 6 и др. Mo O 3 3H 2 Mo 3H 2 O, 2NH 4 Re O 4 4H 2 2Re N 2 8H 2 O.
Слайд 26

Металлотермия используется обычно при восстановлении наиболее устойчивых соединений. Cr 2 O 3 2Al 2Cr Al 2 O 3
Слайд 27

Гидрометаллургия связана с низкотемпературными процессами получения металлов, протекающими в растворах (преимущественно в водных). В гидрометаллургических процессах обычно подбирается растворитель, который переводит в раствор металл и оставляет нерастворенной пустую породу: Cu S Fe 2 (SO 4 ) 3 Cu SO 4 2Fe SO 4 S. Медь из раствора может быть выделена восстановлением более активным металлом или электролизом. Гидрометаллургическим методом отделяют Ag, Au, Pb и другие металлы от пустой породы.
Слайд 28

Выщелачивание металлов из руд с помощью серной кислоты - один из основных процессов гидрометаллургии
Слайд 29

Электрометаллургия включает процессы получения металлов с применением электрического тока – это электротермия и электролиз. При электротермии электрический ток служит источником создания высоких температур (например, выплавка стали в электропечах); при электролизе – используется для непосредственного выделения металлов из соединений.
Слайд 30
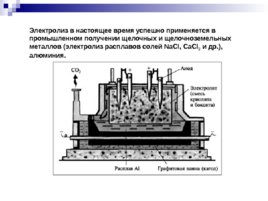
Электролиз в настоящее время успешно применяется в промышленном получении щелочных и щелочноземельных металлов (электролиз расплавов солей Na Cl, Ca Cl 2 и др.), алюминия.
Слайд 31

Химические свойства Химическую активность металлов в компактном состоянии оценивают обычно по энергии ионизации: чем меньше энергия или потенциал ионизации, тем легче атомы отдают электроны и тем активнее металл. В подгруппах s- и р-элементов (сверху вниз) наблюдается значительное увеличение радиуса атома и снижение энергии ионизации. Самые низкие значения энергии ионизации (4–5 э В/моль) имеют щелочные металлы. В подгруппах d-элементов энергия ионизации изменяется немонотонно. При переходе от 5 к 6 периоду возрастание числа электронных слоев компенсируется вследствие лантаноидного сжатия (f-сжатия), вызванного заполнением электронами 4f-подуровня. Поскольку отличие в структуре 4f-элементов (лантаноиды) и 5f-элементов (актиноиды) проявляются в третьем снаружи слое, то это мало влияет на химические свойства элементов и приводит к близким свойствам элементов для каждого из f-семейств.
Слайд 32

Ряд напряжений по существу представляет собой ряд активности, в начале которого располагаются наиболее активные металлы – щелочные и щелочноземельные, за ними следуют металлы средней активности (после Al до Н 2 ), а непосредственно перед водородом и после него находятся малоактивные металлы (Cu, Ag, Au).
Слайд 33

Активные металлы вытесняют из солей менее активные (металлы расположены в порядке убывания активности в ряду напряжений), например, Zn Cu SO 4 Zn SO 4 Cu
Слайд 34

Взаимодействие металлов с неметаллами В результате возможно образование следующих типов соединений: Ме х О у – оксиды. Все металлы, за исключением благородных, непосредственно соединяются с кислородом при различных температурах. Ме х С у – карбиды. Их получают нагреванием порошкообразных металлов с углеродом или с парами углеводородов. Карбиды имеют очень высокую температуру плавления и твердость. Ме х N у – нитриды. Образуются при нагревании металлов с азотом или аммиаком, обладаю высокой твердостью, высокими температурами плавления, проявляют огнеупорные свойства. Ме х Н у – гидриды. Получают при нагревании металлов с водородом.
Слайд 35

Взаимодействие с кислотами В химической практике наиболее часто используются соляная, серная и азотная кислоты. Состав продуктов взаимодействия с ними в значительной степени зависит от концентрации кислоты, активности металла, температуры и других факторов. В СОЛЯНОЙ КИСЛОТЕ и в других бескислородных кислотах роль окислителя играют ионы водорода (Н ), поэтому с ними взаимодействуют металлы, стоящие в ряду напряжений до водорода, вытесняя его: Al 6HCl 2Al Cl 3 3H 2 , Е о (Al/Al 3 ) –1,66 B, Е о (H 2 /2H ) 0,00 B, ЭДС 0 1,66 1,66 В. Металлы, стоящие в ряду напряжений после водорода, с указанными кислотами не взаимодействуют.
Слайд 36

РАЗБАВЛЕННАЯ СЕРНАЯ КИСЛОТА реагирует с металлами различной активности аналогично соляной: 2Al 3H 2 SO 4 Al 2 (SO 4 ) 3 3H 2
Слайд 37

Концентрированная серная кислота служит окислителем особенно при нагревании. Окислителем в этом случае является сульфат-ион SO 4 2- , поэтому с ней взаимодействуют и некоторые металлы, стоящие в ряду напряжений после водорода (Cu, Ag и др.). Приближенно взаимодействие концентрированной серной кислоты с металлами различной активности можно представить схемой: H 2 SO 4 (к) актив. Ме сульфат H 2 S H 2 O ср. акт. Ме сульфат S H 2 O мал. акт. Ме сульфат SO 2 H 2 O
Слайд 38

Например: 8Na 5H 2 SO 4 (к) 4Na 2 SO 4 H 2 S 4H 2 O, 3Cd 4H 2 SO 4 (к) 3Cd SO 4 S 4H 2 O, 2Bi 6H 2 SO 4 (к) Bi 2 (SO 4 ) 3 3SO 2 6H 2 O Некоторые металлы средней активности (Fe, Co, Ni, Cr и др.) пассивируются концентрированной серной кислотой, вероятно, образуя нерастворимые оксиды, и без нагревания с ней не взаимодействуют.
Слайд 39

Взаимодействие разбавленной азотной кислоты с металлами различной активности можно приближенно выразить схемой: HNO 3 (разб.) акт. Ме нитрат NH 3 (NH 4 NO 3 ) H 2 O ср. акт. Ме нитрат N 2 (N 2 O, N 2 O 3 , HNO 2 ) Н 2 O малоакт. Ме нитрат NO H 2 O
Слайд 40

Например, 4Ca 10HNO 3 4Ca(NO 3 ) 2 NH 4 NO 3 3H 2 O, 4Mg 10HNO 3 4Mg(NO 3 ) 2 N 2 O 5H 2 O, 5Co 12HNO 3 5Co(NO 3 ) 2 N 2 6H 2 O, 3Ag 4HNO 3 3Ag NO 3 NO 2H 2 O. Следует помнить, что HNO 3 взаимодействует с металлами практически без выделения водорода , так как роль окислителя в ней играют нитрат-ионы NO 3 - . Чем более разбавлена кислота и активнее металл, тем глубже идет процесс восстановления иона NO 3 - .
Слайд 41

HNO 3 концентрированная является одним из самых сильных окислителей. Основным продуктом восстановления будет NO 2 и только при взаимодействии с наиболее активными металлами (щелочными и щелочноземельными) образуется N 2 O. Концентрированная азотная кислота аналогично серной пассивирует на холоде некоторые довольно активные металлы (Al, Cr, Fe)
Слайд 42

Стандартный электродный потенциал системы 2H 2 O 2ē H 2 2OH - составляет – 0,628B, поэтому с водой взаимодействуют только довольно активные металлы (потенциал которых меньше указанной величины). Причем, взаимодействие протекает с высокой скоростью, если образующийся гидроксид растворим в воде: 2Na 2H 2 O 2Na OH H 2 Взаимодействие металлов с водой
Слайд 43

Взаимодействие металлов со щелочами Со щелочами взаимодействуют только те металлы, оксиды и гидроксиды которых обладают амфотерными свойствами. При этом образуется комплексная соль металла и выделяется газообразный водород из щелочи: 2 Na OH Zn 2H 2 O Na 2 Zn(OH) 4 H 2 или 2 Na OH Zn Na 2 Zn O 2 H 2
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
