Презентация - Биоэнергетика
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 83%
- Слайдов: 81
- Просмотров: 6786
- Скачиваний: 2970
- Размер: 2.88 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика
 Применение антибиотиков в пищевой и консервной промышленности
Применение антибиотиков в пищевой и консервной промышленности
 Обязанности и права военнослужащих
Обязанности и права военнослужащих
 Прохождение военной службы по контракту
Прохождение военной службы по контракту
 Прохождение военной службы по призыву
Прохождение военной службы по призыву
 Организация призыва на военную службу
Организация призыва на военную службу
 Основные понятия о воинской обязанности
Основные понятия о воинской обязанности
Слайды и текст этой онлайн презентации
Слайд 1

Биоэнергетика
Доцент Гончарова Л. В.
Слайд 2

План Цепь переноса электронов и окислительное фосфорилирование; Окислительно-восстановительный потенциал; Переносчики электронов дыхательной цепи Сопряжение окисления и фосфорилирования Ингибирование окислительного фосфорилирования Разобщение окислительного фосфорилирования Бурая жировая ткань Активные формы кислорода
Слайд 3

Слайд 4

Цикл превращений АТФ АТФ универсальный переносчик энергии для клеток; аутотрофы трансформируют энергию солнечного света в энергию химических связей органических веществ; катаболизм органических веществ в клетках гетеротрофов приводит к освобождению энергии и запасанию её в виде АТФ; АТФ используется клетками для различных процессов, требующих энергии.
Слайд 5

Слайд 6

Роль окислительно-восстановительных процессов в метаболизме Основной путь получения энергии гетеротрофами - окисление органических веществ путем дегидрирования. НАД собирает электроны, освобождающиеся в процессе катаболизма в реакциях восстановительного синтеза используются НАДФ H H .
Слайд 7

Коферменты никотиновой кислоты и никотинамида Существуют два кофермента никотиновой кислоты и никотинамида: НАД и НАДФ ; НАД и НАДФ - двухэлектронные переносчики; Они переносят гидрид ионы к и от субстратов.
Слайд 8

Слайд 9

Слайд 10

Сравнение степеней окисления
атомов углерода в биомолекулах
Слайд 11

Окислительно-восстановительные
реакции Окислительно-восстановительные реакции включают транспорт электронов, каждая из реакций состоит из двух сопряженных полуреакций: А(окисленный) В(восстановленный) В(окисленный) А(восстановленный) Окисление – процесс потери электронов. Восстановление – процесс присоединения электронов. В уравнении А является акцептором электронов, В – донор электронов.
Слайд 12

Окислительно-восстановительный
потенциал. Стандартный окислительно-восстановительный
потенциал (редокс потенциал ) для полуреакций – электрический потенциал (E 0 ') в вольтах, измеряемый в течение реакций в стандартных условиях. Для сравнения используется водородный электрод.
Слайд 13

Стандартные условия: - р Н 7; температура 25 0 С; концентрация растворенных веществ 1моль; атмосферное давление 1 атм.
Слайд 14

Слайд 15
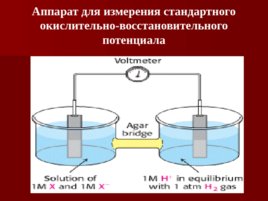
Аппарат для измерения стандартного окислительно-восстановительного потенциала
Слайд 16

Полуреакции E 0 ' (volts) Ацетат 2H 2e - Ацетальдегид -0.60 НАД 2H 2e - НАД H H -0.32 Свободный ФАД 2H 2e - Свободный ФАД H 2 -0.18 Пируват 2H 2e - Лактат -0.19 Фумарат 2H 2e - Сукцинат 0.03 Цитохром c(Fe 3 ) e - Цитохром c (Fe 2 ) 0.25 1/2 O 2 2H 2e - H 2 O 0.82
Слайд 17

Уравнение расчета энергии переноса 2е от НАДН Н к О 2 . G o ' -n F E o ' где G - стандартная свободная энергия реакции; n - число электронов; F - число Фарадея; E - разность между значениями окислительно-восстановительных потенциалов исходных веществ и продуктов реакции .
Слайд 18

Уравнение расчета энергии переноса 2е от НАДН Н к О 2 . E НАДН/ О 2 (О,82-(- О,32) 1,14. G 2 23,065 1,14 52,6 ккал/моль или 220 к Дж/моль. Величина - теоретически достаточна для синтеза 7 АТФ, но синтезируется не более 3- х.
Слайд 19

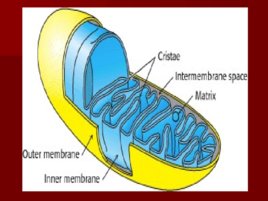
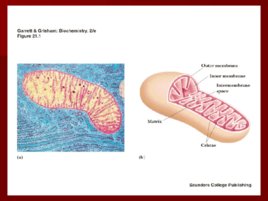
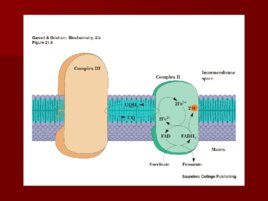
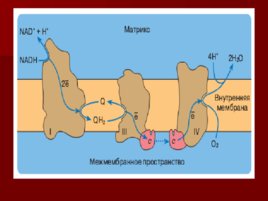
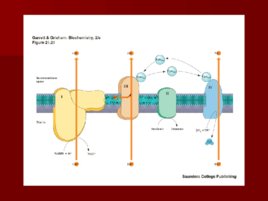
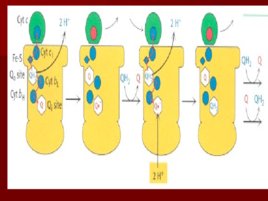
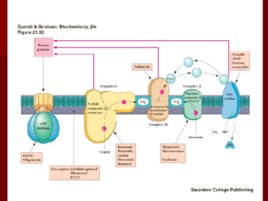
Строение дыхательной цепи
Слайд 20

Строение дыхательной цепи Четыре белковых комплекса расположены во внутренней митохондриальной мембране Жирорастворимый кофермент кофермент Q и водорастворимый цитохром c перемещаются между белковыми комплексами Энергия электронов при их движении по дыхательной цепи снижается
Слайд 21
Слайд 22
Слайд 23
Слайд 24
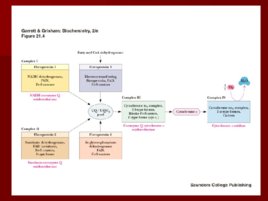
Слайд 25

Комплекс I
НАДН-Ко Q редуктаза Переносит электроны от НАДН к коферменту Q Состоит из более 30 субъединиц масса- 850 k D Путь движения электронов NADH FMN Fe-S UQ Fe S UQ Четыре протона H переходят в межмембранное пространство при переносе 2 -х электронов
Слайд 26
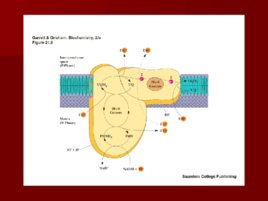
Слайд 27

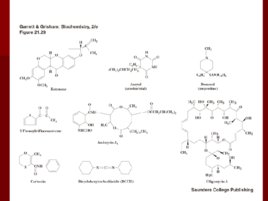
Рибофлавин
(витамин В 2 ) Молекула содержит спирт рибитол и флавин или изоаллоксазиновое кольцо Активные формы витамина – ФМН и ФАД ФМН и ФАД не являются настоящими нуклеотидами, однако традиционные названия до сих пор существуют
Слайд 28

Флавиновые коферменты ФМН и ФАД – одно и двухэлектронные переносчики Название флавин происходит от латинского flavius , что означает желтый Окисленная форма (хинон) является желтой, полухинон – голубой, восстановленная форма не окрашена
Слайд 29
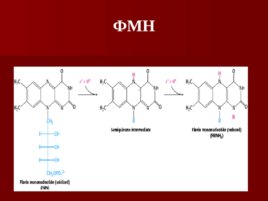
ФМН
Слайд 30

Комплекс II
( сукцинат-кофермент Q редуктаза ) сукцинатдегидрогеназа – фермент цикла Кребса; сукцинатдегидрогеназа – ФАД-зависима; Содержит четыре субъединицы, включая два железосерных центра ( Fe-S ); Содержит три типа Fe-S центров : 4Fe-4S, 3Fe-4S, 2Fe-2S Передача электронов : сукцинат ФАДН 2 2Fe 2 коэнзим QH 2 Суммарная реакция : сукцинат коэнзим Q фумарат коэнзим QH 2
Слайд 31

ФАД
Слайд 32
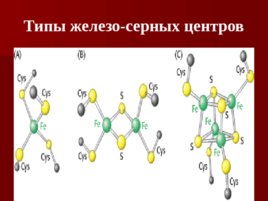
Типы железо-серных центров
Слайд 33
Слайд 34
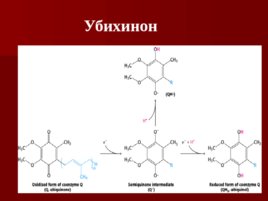
Убихинон
Слайд 35
Слайд 36

Комплекс III
коэнзим Q -цитохром с редуктаза коэнзим Q передаёт электроны на -цитохром с и выкачивает протоны в межмембранное пространство в уникальном цикле, называемом Q циклом; главным белком этого комплекса является цитохром b с гемами bl и b н; цитохромы, как и железосерные центры являются одноэлектронными переносчиками; коэнзим Q – жирорастворимый переносчик электронов; цитохром с – водорастворимый переносчик электронов.
Слайд 37

Слайд 38

Слайд 39

Слайд 40
Слайд 41

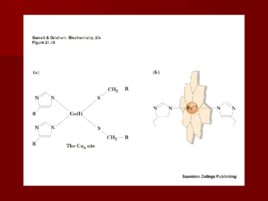
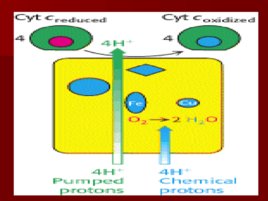
Комплекс IV
цитохром с оксидаза Электроны с цитохрома с используются для четырехэлектронного восстановления молекулы кислорода, что приводит к образованию двух молекул воды; кислород конечный акцептор электронов в дыхательной цепи; цитохром с оксидаза использует два гема (а и а 3 ) и два иона меди; структура комплекса до конца не изучена; комплекс IV также транспортирует протоны водорода.
Слайд 42

Слайд 43
Слайд 44

Слайд 45
Слайд 46
Слайд 47

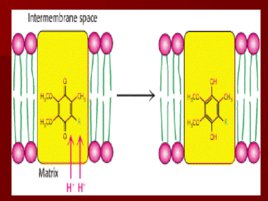
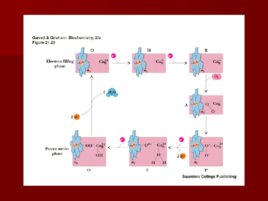
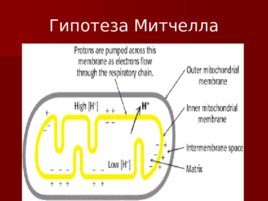
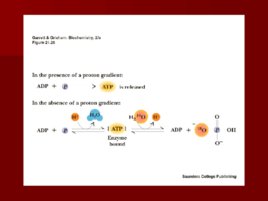
Сопряжение транспорта электронов и окислительного фосфорилирования Много исследователей пытались найти «высокоэнергетический посредник»; Питер Митчелл предложил необычную идею: протонный градиент через внутреннюю митохондриальную мембрану может быть использован для синтеза АТФ; Митчелл был осмеян, но хемиоосмотическая гипотеза позволила ему получить Нобелевскую премию.
Слайд 48
Слайд 49

Q цикл Происходит передача двух электронов с восстановленной формы коэнзима Q : один на цитохром с, другой на коэнзим Q , образуя полухинон . Вновь образованный коэнзим Q диффундирует и замещается новой молекулой QH 2 , которая тоже отдает электроны: один на второй цитохром с, второй на полухинон. Транспорт второго электрона сопровождается выкачиванием двух протонов из матрикса.
Слайд 50

Слайд 51
Слайд 52
Гипотеза Митчелла
Слайд 53

Основные положения теории Митчелла. Перенос электронов по дыхательной цепи от НАД. Н Н к кислороду сопровождается выкачиванием протонов из матрикса митохондрий в межмембранное пространство. Протоны, перенесенные из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создается протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а р Н меньше, чем в матриксе. Каждый протон несет положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал Н – источник энергии для синтеза АТФ.
Слайд 54
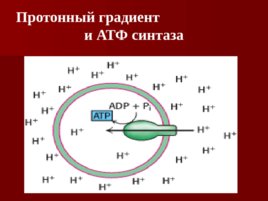
Протонный градиент
и АТФ синтаза
Слайд 55
Слайд 56
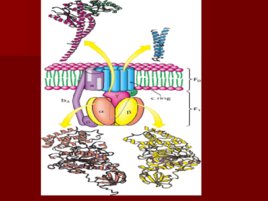
Слайд 57
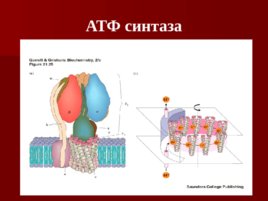
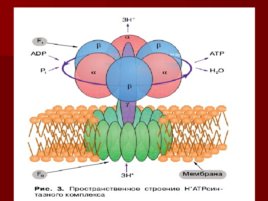
АТФ синтаза
Слайд 58
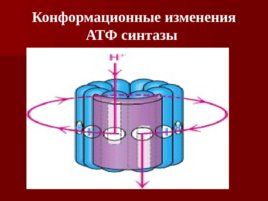
Конформационные изменения АТФ синтазы
Слайд 59
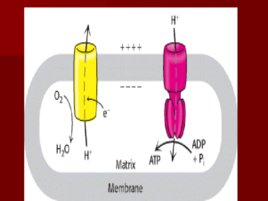
Слайд 60
Слайд 61

Резюме Дыхательная цепь- путь переноса протонов и электронов от органических веществ на кислород воздуха Это система переносчиков, структурно закрепленная в мембране митохондрий и расположенных в соответствии со своими редокс – потенциалами. В процессе переноса электронов по дыхательной цепи создаётся протонный градиент; Окислительное фосфорилирование: поступление протонов обратно в матрикс приводит к синтезу АТФ
Слайд 62

Слайд 63

Ингибиторы окислительного фосфорилирования Ротенон (рыбий яд) ингибирует комплекс I ; Цианиды, азиды и угарный газ ингибируют комплекс IV , взаимодействуя с ферри формой цитохрома а3; олигомицин и дициклогексокарбодиимид ингибируют АТФ синтазу.
Слайд 64
Слайд 65
Слайд 66

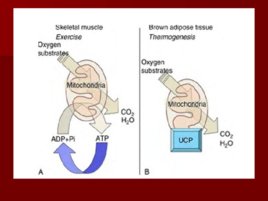
Разобщители Разобщение потока электронов и окислительного фосфорилирования происходит при нарушении протонного градиента; Разобщители являются гидрофобными молекулами, способными диссоциировать; Они перемещаются через мембрану, переносят протоны из межмембранного пространства обратно в матрикс, нарушая протонный градиент.
Слайд 67

Слайд 68
Слайд 69
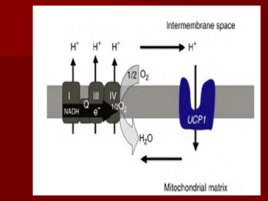
Слайд 70

АТФ-АДФ транслоказа В большинстве клеток синтез основного количества АТФ происходит в митохондриях, а основные потребители АТФ расположены вне её; В мембране есть белок АТФ/АДФ-антипортер, осуществляющий перенос этих метаболитов через мембрану; Молекула АДФ поступает в митохондриальный матрикс только при условии выхода молекулы АДФ из матрикса; Движущая сила такого обмена - мембранный потенциал переноса электронов по ЦПЭ; На транспорт АТФ и АДФ расходуется около четверти свободной энергиипротонного потенциала.
Слайд 71

Слайд 72
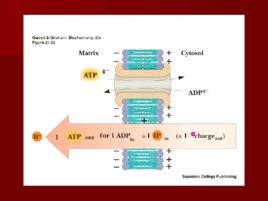
Слайд 73

Коэффициент P/O Означает сколько молекул АТФ синтезируется при передаче пары электронов от субстрата на кислород; Транспорт e - по дыхательной цепи от НАД к кислороду сопровождается синтезом 3 АТФ; Транспорт e - по дыхательной цепи от ФАД к кислороду сопровождается синтезом 2 АТФ.
Слайд 74

Активные формы кислорода. Кислород является потенциально токсическим веществом. Токсичность может возрастать в результате неполного восстановления молекулы кислорода в супероксидный радикал (О 2 - ), который высокотоксичен и может повреждать ДНК, белки и липиды мембран. Супероксид ион опосредует процессы старения.
Слайд 75

Супероксид ион Супероксид ион может образовываться в митохондриях при реакции кислорода с восстановленными ФАД или убихиноном. Детоксикация О 2 - : 2О 2 - 2Н Н 2 О 2 О 2
Слайд 76
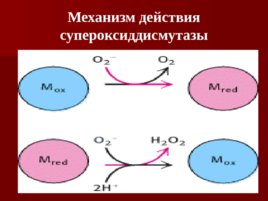
Механизм действия супероксиддисмутазы
Слайд 77

Пероксид водорода Н 2 О 2 так же токсичен и разрушается пероксидазой в следующей реакции: 2Н 2 О 2 2Н 2 О О 2 а. Наиболее распространенная пероксидаза - гемсодержащий фермент каталаза. б. В эритроцитах, глутатион пероксидаза, селенсодержащий фермент, катализирует реакцию, сопутствующую окислению восстановленного глутатиона. в. Витамин С и витамин Е, также принимают участие в детоксикации супероксидного иона и других потенциально опасных свободных радикалов.
Слайд 78

Слайд 79

Биологическое окисление
Слайд 80

Слайд 81

^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
