Презентация - Кислоты
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 83%
- Слайдов: 42
- Просмотров: 3912
- Скачиваний: 1956
- Размер: 2.57 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

КИСЛОТЫ
Слайд 2

Что нас объединяет?
Слайд 3

Кислый вкус лимону придает лимонная кислота, яблоку — яблочная кислота, скисшему молоку — молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
Слайд 4

Кислотами называются сложные вещества, молекулы которых состоят из ионов водорода и кислотных остатков.
HCl – хлороводородная H2SO4 – серная H3PO4 - фосфорная
HCl – хлороводородная H2SO4 – серная H3PO4 - фосфорная
Слайд 5
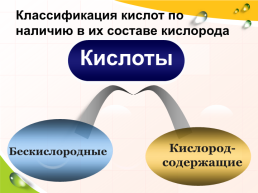
Классификация кислот по наличию в их составе кислорода
Кислород- содержащие
Бескислородные
Кислород- содержащие
Бескислородные
Слайд 6
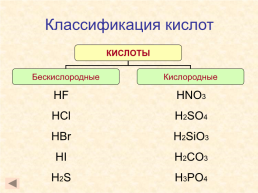
Классификация кислот
HF HCl HBr HI H2S
HNO3 H2SO4 H2SiO3 H2CO3 H3PO4
HF HCl HBr HI H2S
HNO3 H2SO4 H2SiO3 H2CO3 H3PO4
Слайд 7

По какому признаку кислоты разделены на группы?
?
?
?
HF HCl HBr HI HNO3 HClO4
H2S H2SO4 H2SO3 H2CO3 H2SiO3
H3PO4 H3BO3
?
?
?
HF HCl HBr HI HNO3 HClO4
H2S H2SO4 H2SO3 H2CO3 H2SiO3
H3PO4 H3BO3
Слайд 8
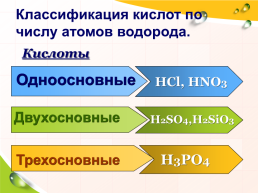
Классификация кислот по числу атомов водорода.
Кислоты
Одноосновные
HCl, HNO3
Двухосновные
H2SO4,H2SiO3
Трехосновные
H3PO4
Кислоты
Одноосновные
HCl, HNO3
Двухосновные
H2SO4,H2SiO3
Трехосновные
H3PO4
Слайд 9
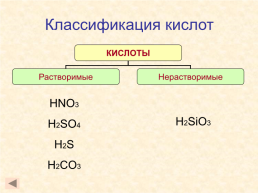
Классификация кислот
HNO3 H2SO4 H2S H2CO3
H2SiO3
HNO3 H2SO4 H2S H2CO3
H2SiO3
Слайд 10
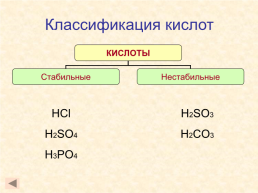
Классификация кислот
HCl H2SO4 H3PO4
H2SO3 H2CO3
HCl H2SO4 H3PO4
H2SO3 H2CO3
Слайд 11
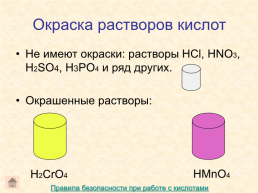
Окраска растворов кислот
Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и ряд других. Окрашенные растворы:
HMnO4
H2CrO4
Правила безопасности при работе с кислотами
Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и ряд других. Окрашенные растворы:
HMnO4
H2CrO4
Правила безопасности при работе с кислотами
Слайд 12

Это интересно
Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Так были открыты индикаторы.
Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Так были открыты индикаторы.
Слайд 13

Немного истории
Индикаторы помогли открыть Р.Бойлю новую кислоту – фосфорную Н3РО4. К середине XVIII века шведскому химику Карлу Шееле удалось выделить несколько новых кислот из корней и листьев различных растений, которым он дал названия в зависимости от вида растений: лимонная, яблочная, щавелевая и т.д.
Индикаторы помогли открыть Р.Бойлю новую кислоту – фосфорную Н3РО4. К середине XVIII века шведскому химику Карлу Шееле удалось выделить несколько новых кислот из корней и листьев различных растений, которым он дал названия в зависимости от вида растений: лимонная, яблочная, щавелевая и т.д.
Слайд 14

Немного истории
За три года до смерти К.Шееле синтезировал в чистом виде еще одну кислоту – синильную HCN. И хотя это один из сильнейших ядов, он описал ее запах и даже попробовал на вкус! Конечно, это не могло пройти бесследно: К.Шееле умер в возрасте всего 44 лет.
За три года до смерти К.Шееле синтезировал в чистом виде еще одну кислоту – синильную HCN. И хотя это один из сильнейших ядов, он описал ее запах и даже попробовал на вкус! Конечно, это не могло пройти бесследно: К.Шееле умер в возрасте всего 44 лет.
Слайд 15

Немного истории
Следующую кислоту – угольную H2CO3 получил впервые в конце XVIII в. Джозеф Пристли Таким образом, к концу XVIII века химики знали уже больше десятка кислот
Следующую кислоту – угольную H2CO3 получил впервые в конце XVIII в. Джозеф Пристли Таким образом, к концу XVIII века химики знали уже больше десятка кислот
Слайд 16
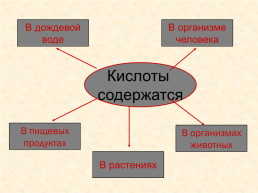
В дождевой воде
В организме человека
Кислоты содержатся
В пищевых продуктах
В организмах животных
В растениях
Слайд 17
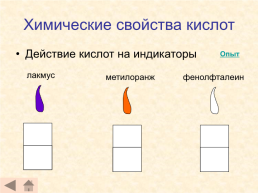
Химические свойства кислот
Действие кислот на индикаторы
Опыт
лакмус
метилоранж
фенолфталеин
Действие кислот на индикаторы
Опыт
лакмус
метилоранж
фенолфталеин
Слайд 18

ПРАВИЛА БЕЗОПАСНОСТИ
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.
Слайд 19
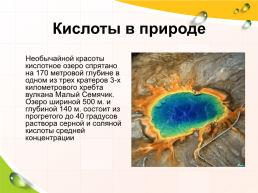
Кислоты в природе
Необычайной красоты кислотное озеро спрятано на 170 метровой глубине в одном из трех кратеров 3-х километрового хребта вулкана Малый Семячик. Озеро шириной 500 м. и глубиной 140 м. состоит из прогретого до 40 градусов раствора серной и соляной кислоты средней концентрации
Необычайной красоты кислотное озеро спрятано на 170 метровой глубине в одном из трех кратеров 3-х километрового хребта вулкана Малый Семячик. Озеро шириной 500 м. и глубиной 140 м. состоит из прогретого до 40 градусов раствора серной и соляной кислоты средней концентрации
Слайд 20

Кислоты в природе
Дождевая вода лишь на первый взгляд кажется чистой. На самом деле в ней растворено немало веществ, в т. ч. кислот: угольной, азотной и иногда даже серной Угольная кислота образуется при растворении в дождевой воде углекислого газа, образующегося в огромных количествах при окислении органических веществ и сгорании топлива
Дождевая вода лишь на первый взгляд кажется чистой. На самом деле в ней растворено немало веществ, в т. ч. кислот: угольной, азотной и иногда даже серной Угольная кислота образуется при растворении в дождевой воде углекислого газа, образующегося в огромных количествах при окислении органических веществ и сгорании топлива
Слайд 21

Кислоты в природе
Азотная кислота образуется при взаимодействии с дождевой водой диоксида азота, образующегося в результате грозовых разрядов. Извержения вулканов и сгорание топлива способствуют появлению в снеговой и дождевой воде серной кислоты
Азотная кислота образуется при взаимодействии с дождевой водой диоксида азота, образующегося в результате грозовых разрядов. Извержения вулканов и сгорание топлива способствуют появлению в снеговой и дождевой воде серной кислоты
Слайд 22

Кислоты в живых организмах
Но не только в дождевой воде есть кислоты. Если летом присесть вблизи муравейника, то надолго запомнятся жгучие укусы его обитателей
Но не только в дождевой воде есть кислоты. Если летом присесть вблизи муравейника, то надолго запомнятся жгучие укусы его обитателей
Слайд 23

Кислоты в живых организмах
Муравей при укусе впрыскивает в ранку яд, содержащий муравьиную кислоту
Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты
Муравей при укусе впрыскивает в ранку яд, содержащий муравьиную кислоту
Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты
Слайд 24

Это интересно
Некоторые крупные млекопитающие используют муравьиную кислоту в своих целях. Так, медведи после зимней спячки избавляются от паразитов, ложась на муравейник. Муравьи, кусая его, впрыскивают муравьиную кислоту, от которой и погибают паразиты
Некоторые крупные млекопитающие используют муравьиную кислоту в своих целях. Так, медведи после зимней спячки избавляются от паразитов, ложась на муравейник. Муравьи, кусая его, впрыскивают муравьиную кислоту, от которой и погибают паразиты
Слайд 25

Кислоты в живых организмах
Плоские тысяченожки используют яд пострашнее – пары синильной кислоты – HCN Некоторые жуки выстреливают парами серной кислоты
Некоторые виды тропических пауков, спасаясь от своих врагов, стреляют в них струйкой жидкости, состоящей на 84% из уксусной кислоты
Паук - плевак
Плоские тысяченожки используют яд пострашнее – пары синильной кислоты – HCN Некоторые жуки выстреливают парами серной кислоты
Некоторые виды тропических пауков, спасаясь от своих врагов, стреляют в них струйкой жидкости, состоящей на 84% из уксусной кислоты
Паук - плевак
Слайд 26

Кислоты в живых организмах
Муравьиной кислотой жжется крапива, некоторые гусеницы
Муравьиной кислотой жжется крапива, некоторые гусеницы
Слайд 27

Кислоты в живых организмах
Лишайники выделяют кислоты,называемые лишайниковыми, которые разрушают горные породы
В мухоморах в качестве токсина содержится иботеновая кислота
Лишайники выделяют кислоты,называемые лишайниковыми, которые разрушают горные породы
В мухоморах в качестве токсина содержится иботеновая кислота
Слайд 28

Это интересно
Иботеновая кислота так ядовита, что мухомору незачем прятаться. Однако лоси жуют мухоморы и не погибают от этого. Скорее – наоборот: мухоморами они лечат какие-то свои «хвори».
Иботеновая кислота так ядовита, что мухомору незачем прятаться. Однако лоси жуют мухоморы и не погибают от этого. Скорее – наоборот: мухоморами они лечат какие-то свои «хвори».
Слайд 29

Кислоты в организме человека
Ряд кислот, играющих важную роль в организме человека ( аскорбиновая, фолиевая, оротовая, пангамовая, никотиновая ), являются витаминами Аминокислоты, соединяясь друг с другом, образуют великое множество белков Молочная кислота является промежуточным продуктом обмена веществ у теплокровных животных и человека.
Ряд кислот, играющих важную роль в организме человека ( аскорбиновая, фолиевая, оротовая, пангамовая, никотиновая ), являются витаминами Аминокислоты, соединяясь друг с другом, образуют великое множество белков Молочная кислота является промежуточным продуктом обмена веществ у теплокровных животных и человека.
Слайд 30

Кислоты в организме человека
0,5 % - ная соляная кислота, входящая в состав желудочного сока, выполняет ряд важных функций: Убивает большую часть бактерий, попадающих в желудок вместе с пищей Создает условия для действия ферментов, расщепляющих белки Фосфорная кислота в виде своих кальциевых, магниевых и стронциевых солей – основной «конструкционный материал» костей, зубов, ногтей
0,5 % - ная соляная кислота, входящая в состав желудочного сока, выполняет ряд важных функций: Убивает большую часть бактерий, попадающих в желудок вместе с пищей Создает условия для действия ферментов, расщепляющих белки Фосфорная кислота в виде своих кальциевых, магниевых и стронциевых солей – основной «конструкционный материал» костей, зубов, ногтей
Слайд 31

Это интересно:
Если воспалительные процессы в желудке больного человека проходят на фоне повышенной кислотности, раковых поражений, как правило, не бывает. Эпидемия холеры возникает только летом, когда из-за жары человек употребляет много воды и кислотность желудочного сока уменьшается У птиц, питающихся падалью, кислотность желудочного сока огромна. Это помогает им расправляться с теми миллиардами микробов, которые буквально кишат в падали
Если воспалительные процессы в желудке больного человека проходят на фоне повышенной кислотности, раковых поражений, как правило, не бывает. Эпидемия холеры возникает только летом, когда из-за жары человек употребляет много воды и кислотность желудочного сока уменьшается У птиц, питающихся падалью, кислотность желудочного сока огромна. Это помогает им расправляться с теми миллиардами микробов, которые буквально кишат в падали
Слайд 32

КИСЛОТЫ в наших продуктах
Слайд 33

Молочная кислота
Молочная кислота образуется при молочнокислом брожении (скисании молока, квашении капусты и др.) под воздействием специальных бактерий. Содержится во всех молочнокислых продуктах.
Молочная кислота образуется при молочнокислом брожении (скисании молока, квашении капусты и др.) под воздействием специальных бактерий. Содержится во всех молочнокислых продуктах.
Слайд 34

Кисломолочные продукты
Кисломолочные продукты вырабатываются из цельного молока или его производных (сливок, обезжиренного молока и сыворотки) сквашиванием самоквасом или заквасками. К кисломолочным продуктам относится творог, сметана, простокваша, кефир, ряженка, ацидофилин и др.
Кисломолочные продукты вырабатываются из цельного молока или его производных (сливок, обезжиренного молока и сыворотки) сквашиванием самоквасом или заквасками. К кисломолочным продуктам относится творог, сметана, простокваша, кефир, ряженка, ацидофилин и др.
Слайд 35

Лимонная кислота
Натуральная лимонная кислота содержится в лимоне, мандаринах, клюкве и других ягодах Она используется при изготовлении кондитерских изделий, компотов, безалкогольных напитков
Натуральная лимонная кислота содержится в лимоне, мандаринах, клюкве и других ягодах Она используется при изготовлении кондитерских изделий, компотов, безалкогольных напитков
Слайд 36

Аскорбиновая кислота
Аскорбиновая кислота, витамин С, противоцинготный витамин Ею богаты смородина, цветная капуста, укроп и другие листовые овощи, плоды и ягоды Особенно много аскорбиновой кислоты содержится в плодах шиповника, незрелого грецкого ореха (до 10 – 12 % сухой массы)
Аскорбиновая кислота, витамин С, противоцинготный витамин Ею богаты смородина, цветная капуста, укроп и другие листовые овощи, плоды и ягоды Особенно много аскорбиновой кислоты содержится в плодах шиповника, незрелого грецкого ореха (до 10 – 12 % сухой массы)
Слайд 37

Яблочная кислота
Яблочная кислота впервые выделена К.Шееле в 1785 г из незрелых яблок. Ею богаты плоды рябины, барбариса, малины, яблони и других растений Применяется при изготовлении фруктовых вод и кондитерских изделий
Яблочная кислота впервые выделена К.Шееле в 1785 г из незрелых яблок. Ею богаты плоды рябины, барбариса, малины, яблони и других растений Применяется при изготовлении фруктовых вод и кондитерских изделий
Слайд 38
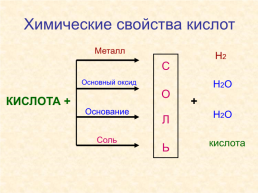
Химические свойства кислот
Металл
Н2
С О Л Ь
Основный оксид
Н2О
КИСЛОТА +
+
Основание
Н2О
Соль
кислота
Металл
Н2
С О Л Ь
Основный оксид
Н2О
КИСЛОТА +
+
Основание
Н2О
Соль
кислота
Слайд 39

Химические свойства кислот
Кислота + металл = соль + водород Ряд активности металлов: Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Zn + H2SO4 =
ZnSO4 + H2 ↑
Сu + H2SO4 = реакция не идет
Кислота + металл = соль + водород Ряд активности металлов: Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Zn + H2SO4 =
ZnSO4 + H2 ↑
Сu + H2SO4 = реакция не идет
Слайд 40

Химические свойства кислот
Кислота + основной оксид = соль + вода
СuO + H2SO4 =
CuSO4 + H2O
Кислота + основной оксид = соль + вода
СuO + H2SO4 =
CuSO4 + H2O
Слайд 41
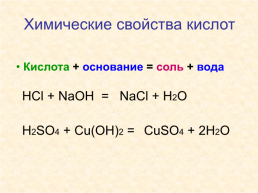
Химические свойства кислот
Кислота + основание = соль + вода
HCl + NaOH =
NaCl + H2O
H2SO4 + Cu(OH)2 =
CuSO4 + 2H2O
Кислота + основание = соль + вода
HCl + NaOH =
NaCl + H2O
H2SO4 + Cu(OH)2 =
CuSO4 + 2H2O
Слайд 42

Химические свойства кислот
Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 =
BaSO4↓ + 2HCl
2. Если выделяется газ:
HNO3 + CaCO3 =
Ca(NO3)2 + H2O + CO2
Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 =
BaSO4↓ + 2HCl
2. Если выделяется газ:
HNO3 + CaCO3 =
Ca(NO3)2 + H2O + CO2
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.