Слайды и текст этой онлайн презентации
Слайд 1
Презентация к уроку химии по теме «Металлы» 11 класс.
Слайд 2
Металлы
Металлы – это элементы, атомы которых легко отдают электроны внешнего
(а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Слайд 4
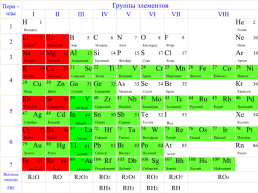
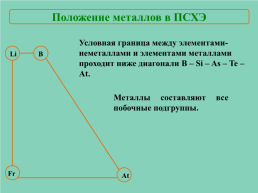
Положение металлов в ПСХЭ
Условная граница между элементами-неметаллами и элементами металлами проходит ниже диагонали B – Si – As – Te – At.
Li
В
Металлы составляют все побочные подгруппы.
Fr
At
Слайд 5
Мы знаем, что…
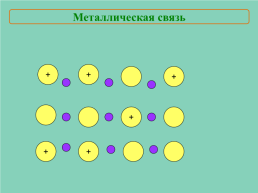
В атомах металлов на внешнем электронном слое небольшое число электронов
Атомы металлов отдают валентные электроны, превращаясь в катионы
Атомы металлов соединяются друг с другом металлической связью
Атомы металлов, соединенные друг с другом металлической связью, образуют простые вещества с металлической кристаллической решеткой
М0 ─ nе ↔ Мn+
атом катион
Слайд 6
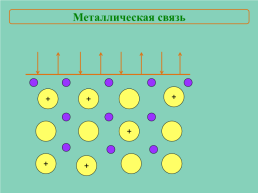
Металлическая связь
+
+
+
+
+
+
Слайд 7
Физические свойства металлов
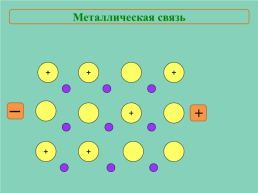
Почему металлы проводят электрический ток и тепло?
электропроводность
теплопроводность
Слайд 8
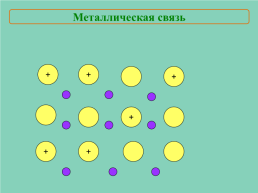
Металлическая связь
+
+
+
─
+
+
+
+
Слайд 9
Физические свойства металлов
Физические свойства металлов.Чем обусловлены свойства?.У каких металлов наиболее выражены
Электропроводность.Наличие «свободных электронов».Ag, Cu, Al
Теплопроводность.Наличие «свободных электронов».Ag, Cu, Al
Слайд 10
Физические свойства металлов
Почему металлы блестят?
Металлы
обладают металлическим
блеском
Слайд 11
Металлическая связь
+
+
+
+
+
+
Слайд 12
Физические свойства металлов
Физические свойства металлов.Чем обусловлены свойства?.У каких металлов наиболее выражены
Металлический блеск.Наличие «свободных электронов».Ag, Hg, Pd
Слайд 13
Физические свойства металлов
Почему металлы гнутся?
Металлы ковки и пластичны
Слайд 14
Металлическая связь
+
Слайд 15
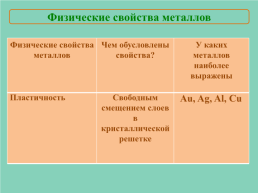
Физические свойства металлов
Физические свойства металлов.Чем обусловлены свойства?.У каких металлов наиболее выражены
Пластичность.Свободным смещением слоев в кристаллической решетке.Au, Ag, Al, Cu
Слайд 16
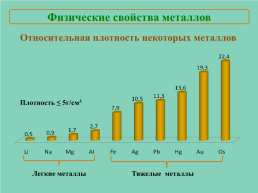
Физические свойства металлов
Относительная плотность некоторых металлов
Плотность ≤ 5г/см3
Легкие металлы
Тяжелые металлы
Слайд 17
Физические свойства металлов
Физические свойства металлов.Чем обусловлены свойства?.У каких металлов наиболее выражены
Плотность.Атомной массой и радиусом атома.Легкие:
Li, Na, Al
Тяжелые:
Fe, Pb, Os
Слайд 18
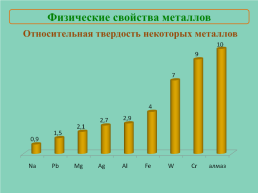
Физические свойства металлов
Относительная твердость некоторых металлов
Слайд 19
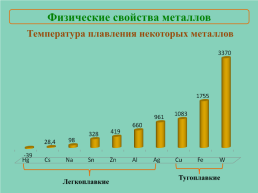
Физические свойства металлов
Температура плавления некоторых металлов
Тугоплавкие
Легкоплавкие
Слайд 20
Физические свойства металлов
Физические свойства металлов.Чем обусловлены свойства?.У каких металлов наиболее выражены
Твердость.От прочности металлической связи (количества электронов, участвующих в образовании связи).W, Cr
Температура плавления.От прочности металлической связи (количества электронов, участвующих в образовании связи).Легкоплавкие:
Cs, Na, Sn
Тугоплавкие:
Cu, Fe, W
Слайд 21
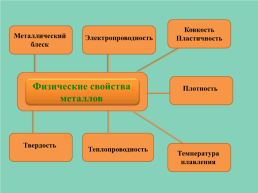
Ковкость
Пластичность
Металлический блеск
Электропроводность
Физические свойства металлов
Плотность
Твердость
Теплопроводность
Температура
плавления
Слайд 22
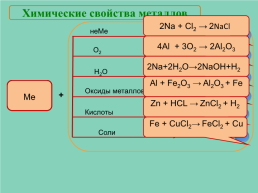
Химические свойства металлов
2Na + Cl2 → 2NaCl
4Al + 3O2 → 2Al2O3
О2
2Na+2Н2О→2NaOH+H2
Al + Fe2O3 → Al2O3 + Fe
+
Zn + HCL → ZnCl2 + H2
Zn+HCl →
Fe + CuCl2→ FeCl2 + Cu
Fe+CuCl2→
Соли
Слайд 23
Особенности химических реакций металлов:
Слайд 24
Взаимодействие металлов с кислотами
M + HmAc → MxAcy + H2↑
Слайд 25
Взаимодействие металлов с растворами солей
M + M/xAcy → MxAcy + М/
Слайд 26
Общие способы получения металлов
Пирометаллургия – получение металлов и сплавов под действием высоких температур.
Гидрометаллургия – получение металлов из водных растворов.
Электрометаллургия – получение металлов под действием электрического тока.
Слайд 27
Общие способы получения металлов
Пирометаллургия
Восстановление углем (угарным газом):
2PbO + C = CO2 + 2Pb
Восстановление алюминием (кальцием):
2Al + Fe2O3 = Al2O3 + 2Fe
Восстановление водородом:
СuO + H2 = Cu + H2O
Слайд 28
Общие способы получения металлов
Гидрометаллургия
1 стадия: растворение в кислоте нерастворимых минералов, содержащих металлы:
CuS + 2HCl = CuCl2 + H2S
2 стадия: вытеснение металлов из растворов их солей более активными металлами:
CuCl2 + Fe = FeCl2 + Cu
Слайд 29
Общие способы получения металлов
Электрометаллургия
Электролиз расплавов:
KCl → K+ + Cl─
катод (─) K+ +1e → K0
анод (+) 2Cl─ ─ 2e → Cl20
эл.ток
2KCl → 2K + Cl2↑
Этим способом в промышленности получают металлы, стоящие в ряду напряжений металлов до Al.
Слайд 30
Коррозия металлов
Самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды, называется коррозией.
Электрохимическая
Химическая
Коррозия железа в контакте с медью и в растворе соляной кислоты:
Катод 2Н+ + 2е = Н2
Анод Fe2+ - 2e = Fe0
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Коррозия железа и образование ржавчины
Слайд 31
Способы защиты металлов от коррозии
Защита более активным металлом;
Отделение металла от агрессивной среды;
Использование замедлителей коррозии;
Электрозащита;
Пассивация металлов;
Изготовление сплавов, стойких к коррозии.
Слайд 32
Список использованной литературы
1. О.С. Габриелян. Учебник для общеобразовательных учреждений. ХИМИЯ. Базовый уровень. 11 класс. – М.: Дрофа, 2007
2. О. С. Габриелян, А. В. Яшукова. Химия. 11 класс. Базовый уровень. Методическое пособие. – М.: Дрофа, 2009.
3. О. С. Габриелян, И. Г. Остроумов. Химия 11 класс: настольная книга учителя. – М.: Дрофа, 2005
Используемые интернет-ресурсы
http://school-sector.relarn.ru/nsm/
http://school-collection.edu.ru/collection/chemistry/
http://www.alhimik.ru
http://all-met.narod.ru
 К уроку химии по теме Моносахариды. Глюкоза, свойства, значение. 10-й класс
К уроку химии по теме Моносахариды. Глюкоза, свойства, значение. 10-й класс Разработка урока по химии в 10 классе по теме «Лекарства и здоровье человека»
Разработка урока по химии в 10 классе по теме «Лекарства и здоровье человека» Интегрированный урок по биологии и химии по теме Чудо фотосинтеза. 10-й класс
Интегрированный урок по биологии и химии по теме Чудо фотосинтеза. 10-й класс К уроку в 7 классе по теме: «изготовление проектного изделия»
К уроку в 7 классе по теме: «изготовление проектного изделия» Урок химии в 10-м классе по теме «Аминокислоты»
Урок химии в 10-м классе по теме «Аминокислоты» К уроку швейного дела (8-й класс коррекционной школы) по теме Раскрой блузки без рукавов и воротника
К уроку швейного дела (8-й класс коррекционной школы) по теме Раскрой блузки без рукавов и воротника К уроку Окружающий мир по теме В царстве грибов. 3-й класс
К уроку Окружающий мир по теме В царстве грибов. 3-й класс