Слайды и текст этой онлайн презентации
Слайд 1
1/17/2023
Практическая работа № 1
Изучение влияния условий проведения химической реакции на её скорость
Слайд 2
Цель работы:
Выяснить влияние различных факторов на скорость протекания химических реакций;
Отработать навыки проведения химического эксперимента.
Слайд 3
Оборудование:
Штатив с пробирками, спиртовка, спички, ложечка для сыпучих веществ, ручной держатель для пробирок, химический стакан.
Растворы соляной кислоты, уксусной кислоты, серной кислоты (1:5) и (1:10), пероксида водорода.
Гранула цинка, расплющенная гранула цинка, оксид меди (II), оксид марганца (IV).
Слайд 4
Ход урока:
Инструктаж по технике безопасности при выполнении практической работы.
Выполнение опытов учащимися.
Оформление отчёта по практической работе.
Подведение итогов .
Слайд 5
Техника безопасности:
Внимательно прочитайте следующие правила:
- Помните об осторожном обращении со стеклом!
- При работе с растворами кислот, щелочей и солей надо соблюдать осторожность! При попадании раствора на кожу или слизистые ткани надо промыть пораженное место большим количеством воды.
- Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
- Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
- При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа .
- Во время проведения эксперимента или оформлении отчёта соблюдай тишину.
- После работы приведи в порядок рабочее место.
Слайд 6
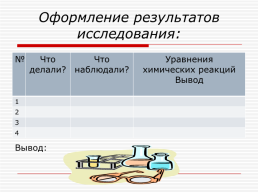
Оформление результатов исследования:
№.Что делали?.Что наблюдали?.Уравнения
химических реакций
Вывод
1...
2...
3...
4...
Вывод:
Слайд 7
Опыт №1. Влияние природы реагирующих веществ на скорость реакции
Посмотрите видеоопыт.
Составьте план решения экспериментальной задачи (Что сделать?)
Выполните эксперимент.
Налейте в две пробирки соляную и уксусную кислоты. В каждую пробирку добавьте кусочек цинка.
Что наблюдали?
Запишите уравнение реакции.
Сделайте вывод.
Слайд 8
Опыт № 2. Влияние температуры на скорость химических реакций
Посмотрите видеоопыт.
Составьте план решения экспериментальной задачи (Что сделать?)
Выполните эксперимент.
В 2 пробирки налейте раствор серной кислоты и добавьте оксида меди (II). Одну пробирку нагрейте.
Что наблюдали?
В какой из пробирок реакция идет быстрее?
Как влияет температура на скорость реакции?
Запишите уравнение реакции.
Сделать вывод.
Слайд 9
Опыт № 3. Влияние концентрации на скорость химических реакций
Посмотрите видеоопыт.
Составьте план решения экспериментальной задачи (Что сделать?)
Выполните эксперимент.
В 1 пробирку налейте раствор серной кислоты (1:5). Во 2 пробирку раствор серной кислоты (1:10) добавьте в каждую оксида меди (II).
В какой пробирке реакция идет быстрее?
Как влияет концентрация реагирующих веществ на скорость реакции? Почему?
Запишите уравнение реакции.
Сделать вывод.
Слайд 10
Опыт № 4. Влияние поверхности соприкосновения реагирующих веществ на скорость
Посмотрите видеоопыт.
Составьте план решения экспериментальной задачи (Что сделать?)
Выполните эксперимент.
Налейте в 2 пробирки соляной кислоты. Добавьте в 1 пробирку гранулу цинка. Во 2 пробирку расплющенную гранулу цинка.
В какой пробирке реакция идет быстрее?
Как зависит скорость реакции от площади соприкосновения веществ?
Запишите уравнение реакции.
Сделать вывод.
Слайд 11
Опыт № 5. Влияние катализатора на скорость химических реакций
Посмотрите видеоопыт.
Составьте план решения экспериментальной задачи (Что сделать?)
Выполните эксперимент.
В пробирку налейте раствор пероксида водорода и добавьте на кончике ложечки оксида марганца (IV).
В какой пробирке реакция идет быстрее?
Как влияет концентрация добавление катализатора на скорость реакции? Почему?
Запишите уравнение реакции.
Сделать вывод.
Слайд 12
Домашнее задание:
Подготовить отчет о проделанной работе
 Практическая работа №1 «Закономерности протекания химических реакций»
Практическая работа №1 «Закономерности протекания химических реакций» Лабораторная работа № 8 «изучение законов сохранения зарядового и массового чисел в ядерных реакциях»
Лабораторная работа № 8 «изучение законов сохранения зарядового и массового чисел в ядерных реакциях» Скорость протекания химических реакций
Скорость протекания химических реакций Урок – практическая работа Характеристика климатических областей с точки зрения условий жизни и деятельности людей на примере событий ноября–декабря месяца 1941 года
Урок – практическая работа Характеристика климатических областей с точки зрения условий жизни и деятельности людей на примере событий ноября–декабря месяца 1941 года Химические реакции - Признаки химических реакций и условия протекания
Химические реакции - Признаки химических реакций и условия протекания Содержание и условия педагогической работы по развитию игровой деятельности на группах старшего дошкольного возраста
Содержание и условия педагогической работы по развитию игровой деятельности на группах старшего дошкольного возраста Создание условий для адресной работы с различными категориями обучающихся в урочной и внеурочной деятельности
Создание условий для адресной работы с различными категориями обучающихся в урочной и внеурочной деятельности