Презентация - Кинетика химических реакций
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 95%
- Слайдов: 29
- Просмотров: 3152
- Скачиваний: 1063
- Размер: 4.65 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Кинетика химических реакций.
Химическое равновесие. ЛЕКЦИЯ № 2
Слайд 2

План Введение. Основные термины. Понятие о скорости гомогенных и гетерогенных реакций. Факторы, влияющие на скорость химических реакций Катализ. Химическое равновесие.
Слайд 3
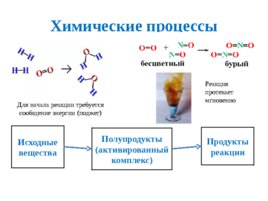
Химические процессы Исходные вещества Полупродукты (активированный комплекс) Продукты реакции Реакция протекает мгновенно Для начала реакции требуется сообщение энергии (поджег)
Слайд 4

Основные термины Кинетика («kinẽtikos движущийся ) – раздел физической химии, изучающий механизм и скорость протекания реакций Механизм реакции – совокупность элементарных стадий Элементарная реакция – превращение исходных веществ в продукты реакции, протекающая в 1 стадию
Слайд 5

Основные термины Скорость химической реакции (W) – изменение концентрации ( C) исходных реагентов или продуктов за единицу времени ( t): Знак « » используют, когда скорость определяется по образующемуся компоненту Знак «-» используют, когда скорость определяется по расходующемуся компоненту
Слайд 6

Химические процессы Гомогенные процессы, протекающие в одной фазе (газ, раствор, расплав) Гетерогенные есть граница раздела фаз (осадок в растворе)
Слайд 7

Скорость химической реакции в гомогенных системах гетерогенных системах где S – площадь поверхности фазы; Δ n – количество вещества, вступающего в реакцию на данной поверхности; Δ t – промежуток времени, в течение которого происходит взаимодействие где Δ С – изменение концентрации; Δ t – промежуток времени, в течение которого происходит взаимодействие
Слайд 8

Факторы, влияющие на скорость реакции: концентрация реагентов, температура, давление, агрегатное состояние реагентов, наличие специфических добавок (катализаторов, ингибиторов)
Слайд 9

выражается законом действующих масс (ЗДМ) Влияние концентрации на скорость химической реакции В 1864 – 1867 годах норвежские ученые Като Максимилиан Гульдберг и Петер Вааге для расчета скорости химической реакции предложили закон действующих масс , который был установлен экспериментальным путем для многих реакций
Слайд 10

Закон действующих масс Для реакции вида а А b B c C d D закон действующих масс выражается формулой υ k С a A С b B, где k – константа скорости реакции, С A и С B – молярные концентрации реагентов, моль/л, а – порядок реакции по реагенту А, b – порядок реакции по реагенту В, n a b – общий порядок реакции
Слайд 11

Закон действующих масс Важно! Концентрация конденсированной фазы не включается в выражение ЗДМ, т.к. она является постоянной величиной. Пример: Са О (к) СО 2 (г) Са СО 3 (к) ЗДМ должен быть записан υ k С СО 2 . для реакции: H 2 O(ж) NH 3 (г) NH 4 OH(ж) ЗДМ имеет вид υ k С NH 3
Слайд 12

ЗАВИСИМОСТЬ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ ПРАВИЛО ВАНТ-ГОФФА где γ – температурный коэффициент, принимающий значения от 2 до 4 Данное правило применимо только если Eaкт 50100 к Дж моль –1
Слайд 13

Энергия активации – избыточное количество энергии, которой должна обладать молекула в момент столкновения, чтобы быть способной к данному химическому взаимодействию («энергетический барьер реакции»)
Слайд 14

УРАВНЕНИЕ АРРЕНИУСА А – частотный фактор (связывает частоту столкновений частиц с вероятностью того, что столкновения будут эффективные), е – основание натурального логарифма, Е акт – энергия активации, Дж/моль, R – универсальная газовая постоянная (8,314 Дж/моль К), T – температура, при которой идет реакция, К. Чем выше температура, тем выше кинетическая энергия частиц, тем быстрее они движутся и чаще сталкиваются друг с другом, а следовательно выше скорость реакции ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ Сва нте А вгуст Арре ниус
Слайд 15

Влияние давления Бенуа Поль Эми ль Клапейро н (1799 —1864) французский физик Менделеев Дмитрий Иванович ( 1834—1907 )
Слайд 16

Влияние степени дисперсности Чем выше степень дисперсности вещества, тем больше площадь его поверхности, тем выше скорость химической реакции
Слайд 17

Влияние специфических добавок Катализатор (Kat) – вещество, которое ускоряет химический процесс, участвуя в нем на этапе образования промежуточных веществ Ингибитор (Ing) – вещество, которое замедляет химический процесс, участвуя в нем на этапе образования промежуточных веществ
Слайд 18

Механизм действия Механизм влияния специфических добавок на скорость химической реакции определяется изменением энергии активации (это энергия необходимая для образования переходного комплекса) Катализатор уменьшает энергию активации, ингибитор увеличивает.
Слайд 19

Типы катализаторов
Слайд 20

Гетерогенный катализ активные центры (группы атомов, метастабильные участки, дефекты, аморфные образования) специфичность катализатор составляет самостоятельную фазу (.. и существует граница раздела): H 2 O 2 H 2 O (губчатая платина) 2NH 3 5/2 O 2 2NO 3H 2 O (Cr 2 O 3 , Fe 3 O 4 , ...) CO 1/2 O 2 CO 2 (дожиг топлива, Pt-Pd; противогаз, Mn O 2 )
Слайд 21
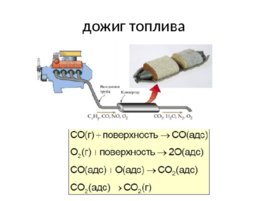
дожиг топлива
Слайд 22

Влияние специфических добавок Вещества, не являющиеся катализаторами, но увеличивающие каталитическую активность называются промоторами Вещества, не являющиеся катализаторами, но снижающие каталитическую активность называются каталитическими ядами
Слайд 23

Равновесие
Слайд 24

Химическое равновесие а А b В с С d D υ пр υ обр υ пр υ обр Химическое равновесие – такое состояние системы, при котором скорость протекания прямой реакции равна скорости протекания обратной
Слайд 25

Константа равновесия , где в приведены концентрации веществ
Слайд 26

Принцип сдвига химического равновесия Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие из вне, то равновесие сместиться в сторону уменьшения этого воздействия Анри Луи Ле Шателье французский физик и химик
Слайд 27
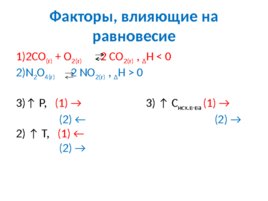
Факторы, влияющие на равновесие 2СО (г) О 2(г) 2 СО 2(г) , Δ H 0 N 2 O 4(г) 2 NО 2(г) , Δ H 0 P, (1) 3) C исх.в-ва (1) (2) (2) 2) T, (1) (2)
Слайд 28

Факторы, влияющие на равновесие 1 Увеличение давления , смещает химическое равновесие в сторону меньшего числа молей газообразных веществ; 2 Повышение температуры способствует протеканию эндотермического процесса, сопровождающегося поглощением тепла; 3 Увеличение концентрации исходных веществ приводит к смещению химического равновесия в сторону образования продуктов реакции
Слайд 29

Список литературы Глинка, Н. Л. Общая химия : учеб. пособие для вузов /
Н. Л. Глинка; под ред. А. И. Ермакова. – 30-е изд., испр. – М.: Интеграл-Пресс, 2007. – 728 с. – Библиогр.: с. 704-705. – Предм. указ.: с. 706-727. – ISBN 5-89602-017-1. Глинка Н. Л. Задачи и упражнения по общей химии : учеб. пособие для вузов / Н. Л. Глинка. М: Химия, 2006. -240 с. . – ISBN 5-89602-015-5 Коровин, Н. В. Общая химия : учеб. для вузов / Н. В. Коровин. – 7-е изд. испр. – М.: Высш. шк., 2006. – 557 с. – (Победитель конкурса учебников). – Прил.: с. 535-545. – Библиогр.: с. 546. – Предм. указ.: с. 547-557. – ISBN 5-06-004403-3. Ахметов, Н. С. Общая и неорганическая химия : Учеб. для вузов / Н. С. Ахметов. – 3-е изд. перераб. и доп. – М.: Высш. шк., 1998. –743 с., ил. – Библиогр.: с. 727. – Предм. указ.: с. 728-736. – ISBN 5-06-003363-5.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







