Презентация - Химиялық реакциялардың жылдамдығы
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 88%
- Слайдов: 26
- Просмотров: 9579
- Скачиваний: 1397
- Размер: 0.18 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Химиялық элементтердің валенттілігі
Химиялық элементтердің валенттілігі
 Русская народная вышивка. Полотенце
Русская народная вышивка. Полотенце
 Закон на защите детства
Закон на защите детства
 Порядок государственной регистрации, лицензирования и прекращения деятельности банков
Порядок государственной регистрации, лицензирования и прекращения деятельности банков
 Зоны с особыми условиями использования территорий
Зоны с особыми условиями использования территорий
 В гостях у тётушки. Мелодии
В гостях у тётушки. Мелодии
 Комплексная система управления «умный дом»
Комплексная система управления «умный дом»
Слайды и текст этой онлайн презентации
Слайд 1

Химиялық реакциялардың жылдамдығы
Орындаған: Байбатыр.Г Тексерген: Тулегенова.Г.У
Слайд 2

Гомогенді және гетерогенді жүйелер
Фаза – химиялық, физикалық қасиеттері және құрамдары бірдей болатын гомогенді жүйелердің жиынтығы.
Гомогенді жүйелер бір фазадан тұрады
Гетерогенные системы
Фаза – химиялық, физикалық қасиеттері және құрамдары бірдей болатын гомогенді жүйелердің жиынтығы.
Гомогенді жүйелер бір фазадан тұрады
Гетерогенные системы
Слайд 3
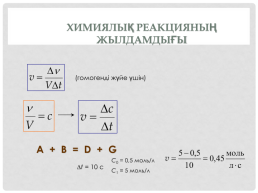
Химиялық реакцияның жылдамдығы
(гомогенді жүйе үшін)
A + B = D + G
C0 = 0,5 моль/л
t = 10 c
C1 = 5 моль/л
(гомогенді жүйе үшін)
A + B = D + G
C0 = 0,5 моль/л
t = 10 c
C1 = 5 моль/л
Слайд 4

Химиялық реакцияның жылдамдығы
A + B = D + G
C0 = 2 моль/л
t = 10 c
C1 = 0,5 моль/л
(гомогенді жүйе үшін)
(гетерогенді жүйе үшін)
A + B = D + G
C0 = 2 моль/л
t = 10 c
C1 = 0,5 моль/л
(гомогенді жүйе үшін)
(гетерогенді жүйе үшін)
Слайд 5

Реакция жылдамдығына әсер ететін факторлар
Әрекеттесуші заттардың табиғаты Жүйедегі заттардың концентрациясы Тығыздық(гетерогенді жүйе үшін) Температура Катализатордың болуы
Әрекеттесуші заттардың табиғаты Жүйедегі заттардың концентрациясы Тығыздық(гетерогенді жүйе үшін) Температура Катализатордың болуы
Слайд 6

Температура әсері
Якоб Вант-Гофф (1852-1911)
Вант-Гофф ережесі Жүйенің температурасы 10 ˚С-қа көтерілгеннен кейін, реакция жылдамдығы 2-4 есе артады
-Вант-Гоффтың темп.коэф-і
Слайд 7

Химиялық технологияның негізгі заңдылықтары.Массалар заңы. Реакторлар.1
Химиялық технология процестері химиялық реакция қатысында жүретін – химиялық және физикалық болып, жүретін реакция бойынша тотығу-тотықсыздану, қышқылдық негіздік, қайтымды, қайтымсыз, жай, күрделі, кинетикалық және диффузиялық салады жүретін болып бөлінеді. Технологиялық аппараттарды жүретін технологиялық процестер гомогенді және гетерогенді болып жіктеледі. Химиялық процестер қайтымды және қайтымсыз болады. Қайтымсыз реакциялар аяғына дейін толық жүреді, ал, қайтымды реакциялар тура және кері бағытта жүретіндіктен оларға тепе-текдік орнау тән болады. Химиялық технологиядағы тепе-теңдік Ле-Шателье принципіне бпғынады. Технологиялық процестердің жылдамдығы реакцияның кинетикалық немесе диффузиялық салада жүретініне байланысты. Жылдамдық әсер етуші массалар заңына бағынады.
Химиялық технология процестері химиялық реакция қатысында жүретін – химиялық және физикалық болып, жүретін реакция бойынша тотығу-тотықсыздану, қышқылдық негіздік, қайтымды, қайтымсыз, жай, күрделі, кинетикалық және диффузиялық салады жүретін болып бөлінеді. Технологиялық аппараттарды жүретін технологиялық процестер гомогенді және гетерогенді болып жіктеледі. Химиялық процестер қайтымды және қайтымсыз болады. Қайтымсыз реакциялар аяғына дейін толық жүреді, ал, қайтымды реакциялар тура және кері бағытта жүретіндіктен оларға тепе-текдік орнау тән болады. Химиялық технологиядағы тепе-теңдік Ле-Шателье принципіне бпғынады. Технологиялық процестердің жылдамдығы реакцияның кинетикалық немесе диффузиялық салада жүретініне байланысты. Жылдамдық әсер етуші массалар заңына бағынады.
Слайд 8

Химиялық технологияның негізгі заңдылықтары.Массалар заңы. Реакторлар. 2
Химиялық реакторлар деп – диффузия, жылу алмасу, араластыру т.б. секілді физикалық құбылыс химиялық өзгеріс тудыруға қажетті жағдай жасайтын, нәтижесінде белгілі массадағы немесе көлемдегі өнім алынатын аппаратты атайды. Реакторға дейін орналасқан аппараттар шикізатты химиялық өңдеуге арналса, реактордан кейінгілері реатордан шыққан өнімді бөлуге негізделген. Реакторға: жоғары өнімділік пен интенсивтілік, жоғары өнім шығымы мен процестің жоғары селективтілігі, жылуды терең пайдалану, технологиялық режим тұрақтылығы, жұмыс қауіпсіздігі, бағасының арзандығы секілді талаптар қойылады. Реакторлар: операция сипатына, әрекеттесуші массаның фазалық құрамына, процестің жылу эффектісіне, қысымға, араластыру дәрежесіне, температуралық режимге байланысты әр түрге бөлінеді. Өндіріс орындарында идеалды шығару, араластыру және аралық операциялы реакторлар моделі жиі кездеседі. Идеалды шығару реакторында барлық бөлшектер белгіленген бағыт бойынша арттағы ағым, алдыдағын толық ығыстыра отырып, қозғалады.
Химиялық реакторлар деп – диффузия, жылу алмасу, араластыру т.б. секілді физикалық құбылыс химиялық өзгеріс тудыруға қажетті жағдай жасайтын, нәтижесінде белгілі массадағы немесе көлемдегі өнім алынатын аппаратты атайды. Реакторға дейін орналасқан аппараттар шикізатты химиялық өңдеуге арналса, реактордан кейінгілері реатордан шыққан өнімді бөлуге негізделген. Реакторға: жоғары өнімділік пен интенсивтілік, жоғары өнім шығымы мен процестің жоғары селективтілігі, жылуды терең пайдалану, технологиялық режим тұрақтылығы, жұмыс қауіпсіздігі, бағасының арзандығы секілді талаптар қойылады. Реакторлар: операция сипатына, әрекеттесуші массаның фазалық құрамына, процестің жылу эффектісіне, қысымға, араластыру дәрежесіне, температуралық режимге байланысты әр түрге бөлінеді. Өндіріс орындарында идеалды шығару, араластыру және аралық операциялы реакторлар моделі жиі кездеседі. Идеалды шығару реакторында барлық бөлшектер белгіленген бағыт бойынша арттағы ағым, алдыдағын толық ығыстыра отырып, қозғалады.
Слайд 9

Химиялық процесстер.1
Химия өнеркәсібінде жүретін процестер энергияны бөлу, сіңіру немесе энергияны басқа түрге ауыстыру арқылы жүреді. Химия өндірісінде қолданылатын энергия түрі технологиялық процесске тәуелді болады. Электр энергиясы электролиз, электрохимия және электромагнит процестерінде пайдаланылады. Химия өнеркәсібінде электр энергиясын шикізатты жару, ұсақтау, араластыру, үрлегіш жұмысы және компрессорға қажетті механикалық энергияға айналдырады. Жылу энергиясы химиялық реакциялармен қатар жүретін физикалық процестерді жүзеге асыру үшін қолданылады.
Химия өнеркәсібінде жүретін процестер энергияны бөлу, сіңіру немесе энергияны басқа түрге ауыстыру арқылы жүреді. Химия өндірісінде қолданылатын энергия түрі технологиялық процесске тәуелді болады. Электр энергиясы электролиз, электрохимия және электромагнит процестерінде пайдаланылады. Химия өнеркәсібінде электр энергиясын шикізатты жару, ұсақтау, араластыру, үрлегіш жұмысы және компрессорға қажетті механикалық энергияға айналдырады. Жылу энергиясы химиялық реакциялармен қатар жүретін физикалық процестерді жүзеге асыру үшін қолданылады.
Слайд 10

Химиялық процесстер.2
Химиялық процесстің жылдамдығын зерттейтін химияның бөлімін – химиялық кинетика деп атайды. Химиялық реакциялар белгілі бір фаза шеңберінде немесе екі фазаның жанасу бетінде жүруі мүмкін. Химияда жүйе деп қарастырылатын затты немесе қоспаны айтады. Бір фазадан тұратын жүйені гомогенді, ал бірнеше фазадан тұратын жүйені гетерогенді жүйе деп атайды, сәйкес жүйеде жүретін реакцияларды гомогенді және гетеоргенді реакциялар деп жіктейді. N2(г) + O2(г) → 2NO – гомогенді реакция C(қ) + O2(г) → CO2 - гетерогенді реакция
Химиялық процесстің жылдамдығын зерттейтін химияның бөлімін – химиялық кинетика деп атайды. Химиялық реакциялар белгілі бір фаза шеңберінде немесе екі фазаның жанасу бетінде жүруі мүмкін. Химияда жүйе деп қарастырылатын затты немесе қоспаны айтады. Бір фазадан тұратын жүйені гомогенді, ал бірнеше фазадан тұратын жүйені гетерогенді жүйе деп атайды, сәйкес жүйеде жүретін реакцияларды гомогенді және гетеоргенді реакциялар деп жіктейді. N2(г) + O2(г) → 2NO – гомогенді реакция C(қ) + O2(г) → CO2 - гетерогенді реакция
Слайд 11

ХИМИЯЛЫҚ ТЕПЕ-ТЕҢДІК
Химиялық тепе-теңдік — бір немесе бірнеше қарама-қарсы жүретін қайтымды реакциялар жылдамдықтарының теңескен күйі. Қайтымды реакция аяғына дейін жүрмейді, ол басталғанда тура жүретін реакцияның жылдамдығы (v1) жоғары, кері реакция жылдамдығы (v2) баяу болады. Тура реакция жүрген сайын реакцияға алынған заттың концентрациясы азайып, v1 — жылдамдығы кемиді, керісінше, тіке реакциядан пайда болған өнімнің концентрациясы артып, v2 күшейеді. Біртіндеп екі реакция жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық тепе-теңдік деп атайды. Тепе-теңдік орнағанмен қарама-қарсы бағытталған екі реакция да тоқтамай жүре береді. Егер сыртқы жағдай (қысым, концентрация, температура) өзгермесе реакция жылдамдықтары тең болып, химиялық тепе-теңдік орнаған қалпында қала береді, сондықтан оны жылжымалы немесе тепе-теңдік деп те атайды. Реакцияласушы жүйенің бір тепе-теңдік күйден басқа басқа тепе-теңдік күйге ауысуын химиялық тепе-теңдіктің ығысуы дейді. Химиялық тепе-теңдік орнаған кездегі реакцияға қатысқан әр заттың концентрациясы тепе-теңдік концентрациясы деп аталады.
Химиялық тепе-теңдік — бір немесе бірнеше қарама-қарсы жүретін қайтымды реакциялар жылдамдықтарының теңескен күйі. Қайтымды реакция аяғына дейін жүрмейді, ол басталғанда тура жүретін реакцияның жылдамдығы (v1) жоғары, кері реакция жылдамдығы (v2) баяу болады. Тура реакция жүрген сайын реакцияға алынған заттың концентрациясы азайып, v1 — жылдамдығы кемиді, керісінше, тіке реакциядан пайда болған өнімнің концентрациясы артып, v2 күшейеді. Біртіндеп екі реакция жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық тепе-теңдік деп атайды. Тепе-теңдік орнағанмен қарама-қарсы бағытталған екі реакция да тоқтамай жүре береді. Егер сыртқы жағдай (қысым, концентрация, температура) өзгермесе реакция жылдамдықтары тең болып, химиялық тепе-теңдік орнаған қалпында қала береді, сондықтан оны жылжымалы немесе тепе-теңдік деп те атайды. Реакцияласушы жүйенің бір тепе-теңдік күйден басқа басқа тепе-теңдік күйге ауысуын химиялық тепе-теңдіктің ығысуы дейді. Химиялық тепе-теңдік орнаған кездегі реакцияға қатысқан әр заттың концентрациясы тепе-теңдік концентрациясы деп аталады.
Слайд 12

Химиялық тепе-теңдікті сан жағынан сипаттайтын көрсеткіш тепе-теңдік константасы (тұрақтысы) (К) деп аталады: aA+bB=pP+qQ, мұндағы бас әріптер — заттардың формулалары, кіші әріптер — реакциядағы молекула сандарын көрсететін коэффициенттер. Тепе-теңдік константасы тура және кері реакциялардың жылдамдық константаларының (k1,k2) қатынасы деп те аталады: K=k1/k2. К — белгілі температурада тура реакция өнімдері мен реакциясы алынған заттардың мольдік көбейтінділерінің қатынасын көрсететін тұрақты шама. Химиялық тепе-теңдікті зерттеудің теориялық және практикалық маңызы бар. Бірдей жағдайда қарама-қарсы екі бағытта жүретін реакцияларды қайтымды деп атайды. N2 + 3H2 ↔ 2NH3 , Fe3O4 + 4H2 ↔ 3Fe + 4H2O. Солдан оңға қарай жазылған реакцияны тура, оңнан солға қарай жазылған реакцияны кері реакция деп атайды. Қайтымсыз реакция деп атау тек шартты түрде ғана:
2КСІО3 → 2КСІ + 3О2, 2Na + 2H2O → 2NaOH + H2.
Химиялық реакция жүрген кезде алғашқы заттардың концентрациялары азаяды, олай болса, әрекеттесуші массалар заңы бойынша реакция жылдамдығы да азаяды. Егер реакция қайтымды болса, белгілі бір уақыт өткен соң кері реакцияның жылдамдығы арта бастайды, себебі реакция нәтижесінде пайда болған заттар концентрациялары артады.
Слайд 13

Егер реакция қайтымды болса, белгілі бір уақыт өткен соң кері реакцияның жылдамдығы арта бастайды, себебі реакция нәтижесінде пайда болған заттар концентрациялары артады. Тура және кері реакциялар жылдамдықтары теңескенде химиялық тепе-теңдік орнайды, енді реакцияға қатысатын заттардың концентрациялары ары қарай өзгермейді. Егер жалпы теңдеуді былай жазса аА + bВ ↔ сС + ▲▲, онда тура реакция жылдамдығы
u→ = k→ [A]a × [B]b; u ← = k ← [C]c × [▲]▲ тепе-теңдік кезінде u→ = u ← , олай болса,
k→ [A]a × [B]b = k ← [C]c × [▲]▲ сонда, k→ /k ← = К т – реакцияның тепе-теңдік константасы болады. Тепе-теңдік константасына кіретін концентрацияларды тепе-теңдік концентрациялары деп атайды. Сонымен, тепе-теңдік константасы сол температурада тұрақты шама, реакция нәтижесінде түзілген заттардың тепе-теңдік концентрациялары көбейтіндісінің реакцияға түскен заттардың тепе-теңдік концентрациялары көбейтіндісіне қатынасын көрсетеді:
К т = [C]c × [▲]▲ /[A]a × [B]b
Слайд 14

Тепе-теңдік константасы – реакцияның маңызды сипаттамасы, оның мәні көп болған сайын, реакция ↔тереңірек» жүреді, яғни реакция нәтижесінде түзілген заттардың шығымы жоғары болады. Гетерогенді реакциялар үшін тепе-теңдік константасы мәніне де қатты заттардың концентрациясы кірмейді, реакциялар жылдамдығы мәніне кірмеген сияқты. Химиялық тепе-теңдік кезінде реакциялар тоқтамайды, тек қарама-қарсы реакциялардың жылдамдықтары теңеседі, уақыт бірлігінде түзілген заттар молекулаларының саны реакцияға түскен заттар молекулалары санына тең болады.Олай болса, химиялық тепе-теңдік динамикалық, жылжымалы болады.Тепе-теңдік константасы реакцияласатын заттар табиғатына және температураға тәуелді, ал концентрацияларына тәуелді емес.
Слайд 15

Тарихы
Химиялық кинетика 19 ғасырдың орта кезінен бастап дамыды. 1850 жылы неміс химигі Л.Вильгельм (1812 — 1864) қамыс қанты инверсиясының, 1862 — 63 жылы француз химигі М.Бертло(1827 — 1907) этерификация реакциясы жылдамдықтарын зерттеп, 1882 — 90 жылы Ресей химигі Н.А. Меншуткин (1842 — 1907) заттың реакцияға бейімділігі мен құрылысының арасындағы тәуелділікті анықтады. Нидерланд ғалымы Я.Вант-Гофф (1852 — 1911) және швед химигі С.Аррениус (1859 — 1927) қарапайым химиялық реакциялардың жүру заңдылықтарын ашты. 20 ғасырдың 30-жылдарында Химиялық кинетиканың кванттық механика, т.б. физиканың жаңа салаларының табыстарына негізделген теориялар пайда болды. Күрделі химиялық процестердің кинетикасын зерттеуде аралық өнімнің және аралық реакциялардың шешуші рөлі жөніндегі көзқарастар дамыды.
Химиялық кинетика 19 ғасырдың орта кезінен бастап дамыды. 1850 жылы неміс химигі Л.Вильгельм (1812 — 1864) қамыс қанты инверсиясының, 1862 — 63 жылы француз химигі М.Бертло(1827 — 1907) этерификация реакциясы жылдамдықтарын зерттеп, 1882 — 90 жылы Ресей химигі Н.А. Меншуткин (1842 — 1907) заттың реакцияға бейімділігі мен құрылысының арасындағы тәуелділікті анықтады. Нидерланд ғалымы Я.Вант-Гофф (1852 — 1911) және швед химигі С.Аррениус (1859 — 1927) қарапайым химиялық реакциялардың жүру заңдылықтарын ашты. 20 ғасырдың 30-жылдарында Химиялық кинетиканың кванттық механика, т.б. физиканың жаңа салаларының табыстарына негізделген теориялар пайда болды. Күрделі химиялық процестердің кинетикасын зерттеуде аралық өнімнің және аралық реакциялардың шешуші рөлі жөніндегі көзқарастар дамыды.
Слайд 16

Химиялық процесс жылдамдығына әсер ететін факторлар.1
Химиялық реакция жылдамдығына әсер ететін маңызды факторларға әрекеттесуші заттар табиғаты, олардың концентрациясы, температура, жүйеге катализатордың (өршіткінің) қатысуы жатады. Гетерогенді реакцияның жылдамдығы кейбір қосымша факторларға тәуелді, оның ішінде реагенттердің жанасу беті маңызды болып табылады. 1. Әрекеттесуші заттар табиғатының әсері. Оттектің сутекпен реакциясы, азоттың сутекпен реакциясына қарағанда тез өтеді, себебі, О = O байланысын үзу үшін 942 кДж/моль энергия, ал N ≡ N байланысын үзуге 494 кДж/моль энергия жұмсалады. Яғни екі байланысқа қарағанда үш байланысты үзу қиынға соғады. 2. Жанасу бетінің әсері. Гетерогенді реакциялардың жылдамдығы жанасу бетіне тәуелді. Гетерогенді реакциялар үшін жоғарыда көрсетілген формуладан шығатыны: гетерогенді реакцияның жылдамдығы жанасу бетінің азаюымен арта түседі. Сондықтан көптеген гетерогенді рекциялардың жылдамдығын арттыру үшін кесек заттарды ұсатады. Нәтижесінде жанасу бетінің ауданы азайып, реакция жылдамдығы артады.
Химиялық реакция жылдамдығына әсер ететін маңызды факторларға әрекеттесуші заттар табиғаты, олардың концентрациясы, температура, жүйеге катализатордың (өршіткінің) қатысуы жатады. Гетерогенді реакцияның жылдамдығы кейбір қосымша факторларға тәуелді, оның ішінде реагенттердің жанасу беті маңызды болып табылады. 1. Әрекеттесуші заттар табиғатының әсері. Оттектің сутекпен реакциясы, азоттың сутекпен реакциясына қарағанда тез өтеді, себебі, О = O байланысын үзу үшін 942 кДж/моль энергия, ал N ≡ N байланысын үзуге 494 кДж/моль энергия жұмсалады. Яғни екі байланысқа қарағанда үш байланысты үзу қиынға соғады. 2. Жанасу бетінің әсері. Гетерогенді реакциялардың жылдамдығы жанасу бетіне тәуелді. Гетерогенді реакциялар үшін жоғарыда көрсетілген формуладан шығатыны: гетерогенді реакцияның жылдамдығы жанасу бетінің азаюымен арта түседі. Сондықтан көптеген гетерогенді рекциялардың жылдамдығын арттыру үшін кесек заттарды ұсатады. Нәтижесінде жанасу бетінің ауданы азайып, реакция жылдамдығы артады.
Слайд 17

Химиялық процесс жылдамдығына әсер ететін факторлар .2
Концентрацияның әсері. aA +b B → cC +d D реакциясы үшін А және В заттары әрекеттесуі үшін олардың молекулалары (бөлшектері) соқытығысуы керек. Соқтығысу неғұрлым көп болса, реакция тез жүреді. Әрекеттесуші заттардың концентрациясы неғұрлым көп болса, соқтығысу саны көп болады. Осыдан химиялық кинетиканың негізгі заңы – әрекеттесуші массалар заңы тұжырымдалады: химиялық реакцияның жылдамдығы стехиометриялық коэффициенттері дәрежесімен алынған әрекеттесуші заттар концентрациясына тура пропорционал. v = k • cAa • cBb Мұндағы k – жылдамдық константасы деп аталатын пропорционалдық коэффициент. k мәні неғұрлым үлкен болса, соғұрлым реакция жылдамдығы артады. Гетерогенді реакциялар үшін кинетикалық теңдеуде қатты заттардың концентрациясы есептелмейді. Өйткені олардың концентрациясы тұрақты, олар ауданы өзгеріссіз қалатын бетте ғана әрекеттеседі.
Концентрацияның әсері. aA +b B → cC +d D реакциясы үшін А және В заттары әрекеттесуі үшін олардың молекулалары (бөлшектері) соқытығысуы керек. Соқтығысу неғұрлым көп болса, реакция тез жүреді. Әрекеттесуші заттардың концентрациясы неғұрлым көп болса, соқтығысу саны көп болады. Осыдан химиялық кинетиканың негізгі заңы – әрекеттесуші массалар заңы тұжырымдалады: химиялық реакцияның жылдамдығы стехиометриялық коэффициенттері дәрежесімен алынған әрекеттесуші заттар концентрациясына тура пропорционал. v = k • cAa • cBb Мұндағы k – жылдамдық константасы деп аталатын пропорционалдық коэффициент. k мәні неғұрлым үлкен болса, соғұрлым реакция жылдамдығы артады. Гетерогенді реакциялар үшін кинетикалық теңдеуде қатты заттардың концентрациясы есептелмейді. Өйткені олардың концентрациясы тұрақты, олар ауданы өзгеріссіз қалатын бетте ғана әрекеттеседі.
Слайд 18

Химиялық процесс жылдамдығына әсер ететін факторлар. Катализ
Температураның әсері. Көптеген химиялық реакциялар жылдамдығы температураның артуымен артады. Химиялық реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесімен сипатталады: Гомогенді жүйелерде температураны әрбір 100С-қа көтергенде химиялық реакцияның жылдамдығы шамамен 2 – 4 есе аралығында артады. Катализатордың (өршіткінің) әсері. Катализ. Көптеген химиялық реакциялар жылдамдығы бірқатар заттардың қатысына тәуелді. Химиялық реакцияның жылдамдығын арттыратын, бірақ өздері өнімнің құрамына кірмейтін заттарды катализаторлар (өршіткілер) деп атайды. Катализатор қатысында жүретін химиялық реакцияны катализ деп атайды. Сонымен қатар керісінше химиялық реакцияның жылдамдығын азайтатын да заттар белгілі. Оларды ингибиторлар (басытқылар) деп атайды.
Температураның әсері. Көптеген химиялық реакциялар жылдамдығы температураның артуымен артады. Химиялық реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесімен сипатталады: Гомогенді жүйелерде температураны әрбір 100С-қа көтергенде химиялық реакцияның жылдамдығы шамамен 2 – 4 есе аралығында артады. Катализатордың (өршіткінің) әсері. Катализ. Көптеген химиялық реакциялар жылдамдығы бірқатар заттардың қатысына тәуелді. Химиялық реакцияның жылдамдығын арттыратын, бірақ өздері өнімнің құрамына кірмейтін заттарды катализаторлар (өршіткілер) деп атайды. Катализатор қатысында жүретін химиялық реакцияны катализ деп атайды. Сонымен қатар керісінше химиялық реакцияның жылдамдығын азайтатын да заттар белгілі. Оларды ингибиторлар (басытқылар) деп атайды.
Слайд 19

Катализ
Гомогенді катализ аралық қосылыстар теориясымен түсіндіріледі. Гомогенді катализде катализатор әрекеттесуші заттармен өте тұрақсыз аралық өнім түзеді де, белсендіру энергиясын кемітеді, сәйкес реакция жылдамдығы артады: А + В → АВ гомогенді реакциясы катализатор қатысында жүргенде, А + кат + В → [А . . . кат . . . В] → АВ + катаралық өнім Гетерогенді катализ адсорбциялық теориямен түсіндіріледі. Газтектес немесе еріген заттардың қатты заттардың бетіне концентрациялануын адсорбция деп атайды. Бетінде адсорбция жүретін заттарды – адсорбент, сіңірілген заттарды – адсорбат деп атайды. Адсорбция процесінде адсорбаттардың химиялық белсенділігі күрт артады да, нәтижесінде химиялық реакция тез жүреді.
Гомогенді катализ аралық қосылыстар теориясымен түсіндіріледі. Гомогенді катализде катализатор әрекеттесуші заттармен өте тұрақсыз аралық өнім түзеді де, белсендіру энергиясын кемітеді, сәйкес реакция жылдамдығы артады: А + В → АВ гомогенді реакциясы катализатор қатысында жүргенде, А + кат + В → [А . . . кат . . . В] → АВ + катаралық өнім Гетерогенді катализ адсорбциялық теориямен түсіндіріледі. Газтектес немесе еріген заттардың қатты заттардың бетіне концентрациялануын адсорбция деп атайды. Бетінде адсорбция жүретін заттарды – адсорбент, сіңірілген заттарды – адсорбат деп атайды. Адсорбция процесінде адсорбаттардың химиялық белсенділігі күрт артады да, нәтижесінде химиялық реакция тез жүреді.
Слайд 20

Катализ
Вильгельм Оствальд 1909 г. – Нобелевская премия «в признание работ по катализу»
Йенс Якоб Берцелиус ввел термин «катализ» в 1835 г.
Катализатор –Реакцияның аралық сатысында қолданылатын, бірақ реакция өнімінің құрамына кірмейтін, реакция жылдамдығын өзгертетін зат
2SO2 (г.) + O2 (г.) 2SO3 (г.)
1) 2NO (г.) + O2 (г.) 2NO2 (г.)
2) SO2 (г.) + NO2 (г.) SO3 (г.) + NO (г.)
Вильгельм Оствальд 1909 г. – Нобелевская премия «в признание работ по катализу»
Йенс Якоб Берцелиус ввел термин «катализ» в 1835 г.
Катализатор –Реакцияның аралық сатысында қолданылатын, бірақ реакция өнімінің құрамына кірмейтін, реакция жылдамдығын өзгертетін зат
2SO2 (г.) + O2 (г.) 2SO3 (г.)
1) 2NO (г.) + O2 (г.) 2NO2 (г.)
2) SO2 (г.) + NO2 (г.) SO3 (г.) + NO (г.)
Слайд 21

Каталитикалық процестер және жанасу аппараттары
Катализ деп – катализаторлық заттардың реагенттермен аралық химиялық реакцияға түсу арқылы процесті өзінің құрамын қалпына келтіру арқылы аяқтап, химиялық реакцияның жылдамдығын өзгертуін айтады. Реагенттің және катализатордың фазалық құрамына байланыстыкаталитикалық процестер гомогенді және гетерогенді болып бөлінеді. Катализатордың реакция жылдамдығын арттыруы реагенттер мен катализатордан аралық тұрақсыз комплекстердің түзіліп, химиялық реакция жүріп өткеннен кейін реакция өнімінің және катализатордың қайта қалпына келуіне негізделген. Бірақ, катализ процесінде негізгі реакциядан басқа қосымша реакциялар да жүретіндіктен катализатор құрамы уақыт өте келе өзгеріп, активтілігі жойылады.
Катализ деп – катализаторлық заттардың реагенттермен аралық химиялық реакцияға түсу арқылы процесті өзінің құрамын қалпына келтіру арқылы аяқтап, химиялық реакцияның жылдамдығын өзгертуін айтады. Реагенттің және катализатордың фазалық құрамына байланыстыкаталитикалық процестер гомогенді және гетерогенді болып бөлінеді. Катализатордың реакция жылдамдығын арттыруы реагенттер мен катализатордан аралық тұрақсыз комплекстердің түзіліп, химиялық реакция жүріп өткеннен кейін реакция өнімінің және катализатордың қайта қалпына келуіне негізделген. Бірақ, катализ процесінде негізгі реакциядан басқа қосымша реакциялар да жүретіндіктен катализатор құрамы уақыт өте келе өзгеріп, активтілігі жойылады.
Слайд 22

Катализатор активтілігі.1
Катализатор активтілігі деп – оның реакцияны жыламдата алатын мөлшерін айтады. Активтілік катализатор құрамына, өлшеміне және беттік сипатына технологиялық режим жағдайына тәуелді. Катализатор активтілігі жанасу немесе каталитикалық улар деп аталатын қоспалардың әсері нәтижесінде де жойылады. Катализаторлардың улануы оның бетіне удың сорбциялануы нәтижесінде іске асатындықтан, қайтымды және қайтымсыз улану түрлері болады.
Катализатор активтілігі деп – оның реакцияны жыламдата алатын мөлшерін айтады. Активтілік катализатор құрамына, өлшеміне және беттік сипатына технологиялық режим жағдайына тәуелді. Катализатор активтілігі жанасу немесе каталитикалық улар деп аталатын қоспалардың әсері нәтижесінде де жойылады. Катализаторлардың улануы оның бетіне удың сорбциялануы нәтижесінде іске асатындықтан, қайтымды және қайтымсыз улану түрлері болады.
Слайд 23

Катализатор активтілігі.2
Гомогенді каталитикалық процестер табиғатта кең таралған. Белоктың синтезделуі, зат алмасу процесі, күрделі эфир этерификациясы, метанның формальдегидке тотығуы бұған мысал бола алады. Гомогендідегі каталитикалық механизм - әрекеттесуші заттар мен катализатор арасында бөлініп алынатын немесе аналитикалық тәсілмен анықталатын аралық қосылыстырдың түзілуіне негізделген. Гомогенді катализ жылдамдығына: катализатор активтілігі, температура және араластыру интенсивтілігі әсер етеді. Гетерогенді катализ гомогендіге қарағанда өндірісте кең тараған. Гетерогенді каталитикалық процесс – газ тәрізді заттар мен қатты катализатор арасындағы реакцияға негізделген. Қатты катализатор - ішкі кеңістігі жақсы дамыған кеуекті қатты дене.
Гомогенді каталитикалық процестер табиғатта кең таралған. Белоктың синтезделуі, зат алмасу процесі, күрделі эфир этерификациясы, метанның формальдегидке тотығуы бұған мысал бола алады. Гомогендідегі каталитикалық механизм - әрекеттесуші заттар мен катализатор арасында бөлініп алынатын немесе аналитикалық тәсілмен анықталатын аралық қосылыстырдың түзілуіне негізделген. Гомогенді катализ жылдамдығына: катализатор активтілігі, температура және араластыру интенсивтілігі әсер етеді. Гетерогенді катализ гомогендіге қарағанда өндірісте кең тараған. Гетерогенді каталитикалық процесс – газ тәрізді заттар мен қатты катализатор арасындағы реакцияға негізделген. Қатты катализатор - ішкі кеңістігі жақсы дамыған кеуекті қатты дене.
Слайд 24

Катализатор активтілігі.3
Қатты катализаторлар көптеген технологиялық талаптарға сай болуы керек, атап айтқанда: берілген реакцияға активті, каталитикалық уларға тұрақты, бағасы арзан, механикалық бері, термиялық тұрақты, белгілі дәрежеде жылу өткізгіш және т.б. сондықтан катализаторлар бір ғана заттан емес, жанасу массасы деп аталатын күрделі механикалық қоспадан тұрады. Жанасу массасы негізгі 3 бөліктен: катализатор, активатор және тасымалдағыш немесе трегер. Кез келген технологиялық процестегі негізгі көрсеткіш: қондырғының өнімділігін сипаттайтын процестің жүру жылдамдығын және шикізаттың қолданылу тереңдігін анықтайтын – дайын өнім шығымы. Каталитикалық процестер жүзеге асатын химиялық реакторлар жылдамдығы: катализатор активтілігіне, температураға, әрекеттесуші заттың концентарциясы мен табиғатына және қысымға тәуелді болады.
Қатты катализаторлар көптеген технологиялық талаптарға сай болуы керек, атап айтқанда: берілген реакцияға активті, каталитикалық уларға тұрақты, бағасы арзан, механикалық бері, термиялық тұрақты, белгілі дәрежеде жылу өткізгіш және т.б. сондықтан катализаторлар бір ғана заттан емес, жанасу массасы деп аталатын күрделі механикалық қоспадан тұрады. Жанасу массасы негізгі 3 бөліктен: катализатор, активатор және тасымалдағыш немесе трегер. Кез келген технологиялық процестегі негізгі көрсеткіш: қондырғының өнімділігін сипаттайтын процестің жүру жылдамдығын және шикізаттың қолданылу тереңдігін анықтайтын – дайын өнім шығымы. Каталитикалық процестер жүзеге асатын химиялық реакторлар жылдамдығы: катализатор активтілігіне, температураға, әрекеттесуші заттың концентарциясы мен табиғатына және қысымға тәуелді болады.
Слайд 25

Пайдаланылған әдебиеттер
1) Жанмолдаева Ж. К. Химиялық технологияның негіздері, мысалдары және есептері. Оқу құралы.-Шымкент: М.О.Әуезов ат. ОҚМУ, 2004-79б. 2) Основы химической технологии/ под ред. И.П. Мухленова.-М.: Высш. шк. 1991. 3) Интернет беттері: https://kk.wikipedia.org/wiki/химиялық_технология
1) Жанмолдаева Ж. К. Химиялық технологияның негіздері, мысалдары және есептері. Оқу құралы.-Шымкент: М.О.Әуезов ат. ОҚМУ, 2004-79б. 2) Основы химической технологии/ под ред. И.П. Мухленова.-М.: Высш. шк. 1991. 3) Интернет беттері: https://kk.wikipedia.org/wiki/химиялық_технология
Слайд 26

^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
