Слайды и текст этой онлайн презентации
Слайд 1
Вопросы.
1. Какие типы реакций по признаку «число и состав исходных веществ и продуктов реакции» вы знаете?
2. Какие вы знаете реакции по условиям протекания?
3. Дать определение реакции разложения.
4. Дать определение реакции соединения.
Слайд 2
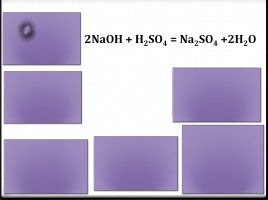
Это реакция обмена
Реакция обратимая
Продукты реакции – соль и вода
Сумма коэффициентов равна 6
реакция нейтрализа-ции
ДА
нет
ДА
нет
ДА
нет
ДА
нет
ДА
нет
Реакция каталитическая
ДА
нет
2NaOH + H2SO4 = Na2SO4 +2H2O
Слайд 3
Третий «лишний»
1. 2HgO → 2Hg + O2
2. Zn + H2SO4 →ZnSO4 + H2
3. 2KNO3 →2KNO2 + O2
1. 4Р + 5О2 →2Р2О5
2. 2S + O2 → 2SO3
3. Zn + CuSO4 → Cu + ZnSO4
1. 2Al + 6HCl → 2AlCl3 + 3H2
2. NaOH + HCl → NaCl + H2O
3. BaCl2 + AgNO3 → Ba(NO3)2 + AgCl
Слайд 4
Реакции замещения
8 класс
4
19.10.2015
Слайд 5
Что мы должны узнать на уроке
I. Дать определение реакций замещения, рассмотреть сущность протекания реакций замещения.
II. Познакомиться с:
1) электрохимическим рядом напряжений металлов;
2) условиями взаимодействия металлов с растворами кислот и солей.
III. Продолжить формирование умений составлять уравнения реакций и расставлять коэффициенты.
Слайд 6
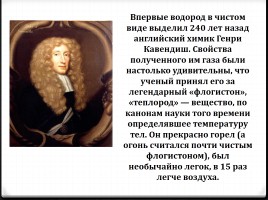
Впервые водород в чистом виде выделил 240 лет назад английский химик Генри Кавендиш. Свойства полученного им газа были настолько удивительны, что ученый принял его за легендарный «флогистон», «теплород» — вещество, по канонам науки того времени определявшее температуру тел. Он прекрасно горел (а огонь считался почти чистым флогистоном), был необычайно легок, в 15 раз легче воздуха.
Слайд 7
Великий химик, француз Антуан-Лоран Лавуазье, уже в 1787 году доказал, что полученное Кавендишем вещество — вполне обычный, хотя и очень интересный химический элемент. Свое название он получил оттого, что при горении давал не дым, сажу и копоть, а воду.
Слайд 8
H
H
Cl
Cl
Вытеснение водорода из кислот.
Zn
Zn + 2HCl = ZnCl2 + H2
Слайд 9
+ С = АС + В
Реакция замещения
Реакции замещения -
это реакции, в результате, которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
А
Слайд 10
Электрохимический ряд напряжений
Правило 1:
Каждый из металлов, расположенных в ряду напряжений до водорода вытесняет водород из водных растворов кислот.
Образованная соль должна быть растворима.
Li, K, Ca, Na, Mg, Al, Mn, Zn, Fe, Pb, H2, Cu, Ag, Au
1.Zn + H2SO4 =
2. Fe + H2SO4 =
3. Au + H2SO4 =
Металлы расположенные до Al в водных растворах кислот вытесняют водород из воды.
Слайд 11
Вытеснение металлов из солей
Правило 2: В реакциях между металлами и солями:
Каждый металл вытесняет из солей (в водных растворах) все те металлы, которые стоят правее его в электрохимическом ряду.
Новая соль должна быть растворима.
Закончить уравнения практически осуществимых реакций:
1. Fe + CuCl2 =
2. Fe + ZnCl2 =
3. Fe + HgCl2 =
4. Fe + AlCl3 =
Li, Ca, Na, Mg, Al, Mn, Zn, Fe, Pb, H2, Cu, Hg, Ag.
Слайд 12
Проверка
1. Fe + CuCl2 = FeCl2 + Cu
2. Fe + ZnCl2 = не идет
3. Fe + HgCl2 = FeCl2 + Hg
4. Fe + AlCl3 = не идет
Слайд 13
Вопросы.
1. С каким типом реакций по признаку «число и состав исходных веществ и продуктов реакции» вы познакомились?
2. Дать определение реакции замещения.
3. Какие металлы вытесняют водород из кислот?
4. Правило вытеснения металлов из солей.
Слайд 14
Домашнее задание
Записи в тетради. Знать определения реакций соединения, разложения, обмена, замещения.
Выполнить задания на карточке.
Слайд 15
Определите тип химической реакции. Вставьте вместо вопросов формулы. Расставьте коэффициенты.
Zn + ? = ZnO
Al + CuCl2 = Cu + ?
Zn + H2SO4 = ZnSO4 + ?
Слайд 16
Дописать следующие уравнения реакций и определить их тип:
H2O = H2 + ?
Cu(OH)2= CuO + ?
CuCI2 + Mg =
CuSO4 + Zn=
Mg + O2 =
 Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Лабораторная работа № 8 «изучение законов сохранения зарядового и массового чисел в ядерных реакциях»
Лабораторная работа № 8 «изучение законов сохранения зарядового и массового чисел в ядерных реакциях» Роль воды в химических реакциях
Роль воды в химических реакциях Окислительно-восстановительные реакции или овр
Окислительно-восстановительные реакции или овр Типы химических реакций
Типы химических реакций Классификация химических реакций
Классификация химических реакций Развитие реакции на сигнал
Развитие реакции на сигнал