Слайды и текст этой онлайн презентации
Слайд 1
Муниципальное образовательное учреждение
Средняя общеобразовательная школа №27
«Электролиз»
Выполнили: ученицы 11 класса
Воропаева Ю.М, Фомичева А.В.
Учитель: Черникова О.Б.
Воронеж 2010
Слайд 2
Явление выделения составных частей растворенных в
жидкости веществ при прохождении через жидкость
электрического тока называется электролизом
Слайд 3
При плавлении электролиты распадаются на ионы, только в отличии от ионов водных растворах такие ионы не гидратиро-
ваны. При пропускании электрического тока через расплав
ионы направляются к противоположно заряженным электро-
дам и разряжаются на них .
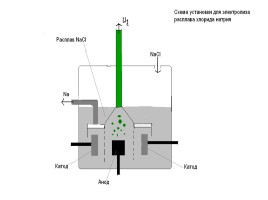
Рассмотрим электролиз расплава хлорида натрия. В расплаве
Эта соль диссоциирует: NaCI=Na+CI.
Катионы натрия направляются к катоду (отрицательному полюсу источника тока) и разряжаются на нем, т.е. восстанавливаются: Na+1e=Na
Хлорид-анионы направляются к аноду(положительному полюсу источника тока) и разряжаются на нем, т. е. окисляются: CI-2e=CI
Итоговое уравнение электролиза расплава хлорида натрия:
2NaCI(расплав)=2Na+CI
Слайд 5
Процесс на катоде зависит не от материала катода, из которого он сделан, а от положения металла(катиона электролита) в электрохимическом ряду напряжений, при этом если:
Катион электролита расположен в ряду напряжений в начале ряда(по алюминий включительно), то на катоде идет процесс восстановления воды(выделяется водород). Катионы металла не восстанавливаются, они остаются в растворе.
Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются
одновременно ионы металла, и молекулы воды.
Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящего в руду напряжений правее.
Слайд 7
Процесс на аноде зависит от материала анода и от природы аниона.
Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
Если анод не растворяется( его называют инертным – графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородосодержащих кислот и фторидов на аноде идет процесс окисления воды(выделяется кислород). Анионы не окисляются, они остаются в растворе;
в)анионы по их способности окисляться располагаются в следующем порядке:
I Br S CI OH
Слайд 8
В промышленности электролиз находит широкое применение:
Для получения щелочных, щелочноземельных металлов и алюминия;
Для получения галогенов, водорода и кислорода;
Для нанесения металлических покрытий на поверхность изделий – никелирование, хромирование, золочение(общее название таких процессов – гальваностегия);
Для изготовления рельефных металлических копий (гальванопластика);
Для очистки цветных металлов от примесей (рафинирование).
Слайд 9
Литература
Большая Энциклопедия
Составитель А.А. Лунин
Москва 2005
 Химические источники тока. Электролиз (химия)
Химические источники тока. Электролиз (химия) Сущность электролиза как способа получения веществ
Сущность электролиза как способа получения веществ Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Электрический ток в жидкостях. Закон электролиза
Электрический ток в жидкостях. Закон электролиза Электролитическая диссоциация
Электролитическая диссоциация Электролитическая диссоциация
Электролитическая диссоциация Cерная кислота как электролит
Cерная кислота как электролит