Слайды и текст этой онлайн презентации
Слайд 1
Химия – через волшебную трубу
Химические формулы
8 класс
Создатель: Гираев Н.С. учитель химии высшей категории
МКОУ «Сертильская СОШ» Табасаранского района Республики Дагестан
2020 г
«Неорганические»
Создатель: Гираев Н.С.
учитель химии
МКОУ «Сертильская СОШ»
Республика Дагестан
Слайд 2
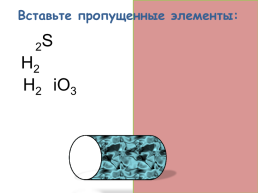
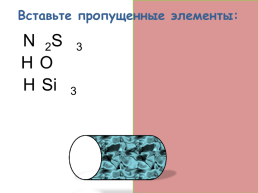
Вставьте пропущенные элементы:
H2S
H2O
H2SiO3
Слайд 3
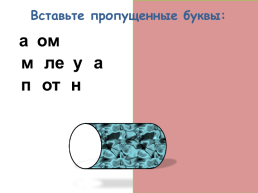
Вставьте пропущенные буквы:
атом
молекула
протон
Слайд 4
Вставьте пропущенные элементы:
Na2SO3
H2O
H2SiO3
Слайд 5
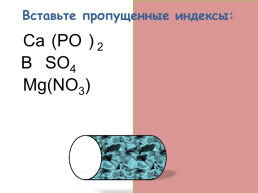
Вставьте пропущенные индексы:
Ca3(PO4) 2
Ba SO4
Mg(NO3) 2
Слайд 6
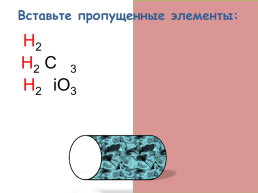
Вставьте пропущенные элементы:
H2S
H2 CO3
H2SiO3
Слайд 7
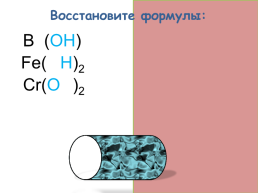
Восстановите формулы:
Ba(OH)2
Fe(OH)2
Cr(OH)2
Слайд 8
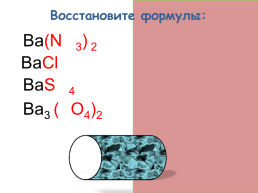
Восстановите формулы:
Ba(NO3) 2
BaCl2
BaSO4
Ba3 (PO4)2
Слайд 9
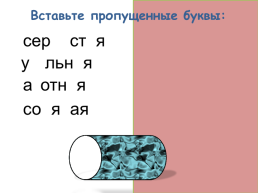
Вставьте пропущенные буквы:
сернистая
угольная
азотная
соляная
Слайд 10
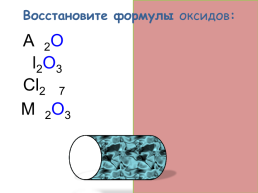
Восстановите формулы оксидов:
Ag2O
Al2O3
Cl2O7
Mn2O3
Слайд 11
Восстановите электронные формулы:
1s2 2s2 2p6 3s2 3p6 4s2 3d1 4p6
1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p0
1s2 2s2 2p6 3s2 3p6 4s2 3d0 4p0
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Слайд 12
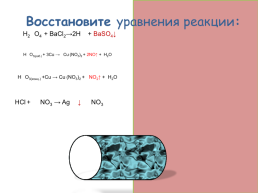
Восстановите уравнения реакции:
H2SO4 + BaCl2→2HСl + BaSO4↓
8HNO3(раб.) + 3Cu → 3Cul(NO3)2 + 2NO↑ +4H2O
4HNO3(конц.) +Cu → Cul(NO3)2 + 2NO2↑ +2H2O
HCl + AgNO3 → AgCl ↓+ HNO3
Слайд 13
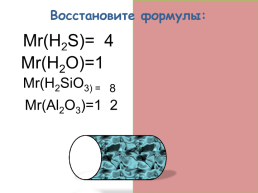
Восстановите формулы:
Mr(H2S)=34
Mr(H2O)=18
Mr(H2SiO3) = 78
Mr(Al2O3)=102
Слайд 14
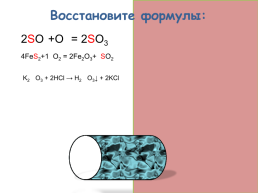
Восстановите формулы:
2SO2+O2 = 2SO3
4FeS2+11O2 = 2Fe2O3+8SO2
K2SiO3 + 2HCl → H2SiO3↓ + 2KCl
Слайд 15
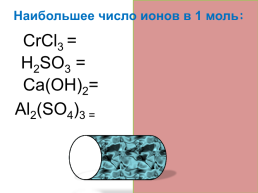
Наибольшее число ионов в 1 моль:
CrCl3 =4
Н2SО3 =3
Cа(OH)2=3
Al2(SO4)3 = 5
Слайд 16
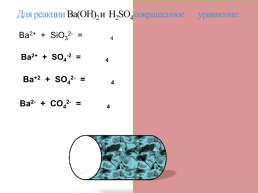
Для реакции Ва(OH)2 и H2SO4 сокращенное уравнение:
Ва2+ + SiO32- = ВаSO4
Ва2+ + SO4-2 = ВаSO4
Вa+2 + SO42- = ВаSO4
Ва2- + CO42- = ВаSO4
Слайд 17
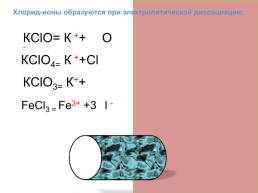
Хлорид-ионы образуются при электролитической диссоциации:
КClО= К ++ ClО -
КClО4= К ++ClО -
КClО3= К++ClО -
FeСl3 = Fe3+ +3Cl -
Слайд 18
Выделение осадка наблюдается между:
Ba2+ и CO32- да
H+ и SO32- нет
H+ и SiO32- да
H+ и CO32- нет
Слайд 19
Оксид серы(VI) не реагирует с :
CO2
H2O+SO3
BaO +SO3
Ca(OH)2+SO3
Слайд 20
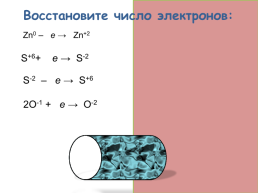
Восстановите число электронов:
Zn0 – 2е → Zn+2
S+6+ 8е → S-2
S-2 – 8е → S+6
2О-1 + 2е → О-2
Слайд 21
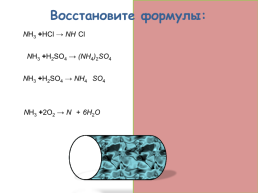
Восстановите формулы:
NH3 +HCl → NH4Cl
2NH3 +H2SO4 → (NH4)2SO4
NH3 +H2SO4 → NH4HSO4
4NH3 +2O2 → N2 + 6H2O
Слайд 22
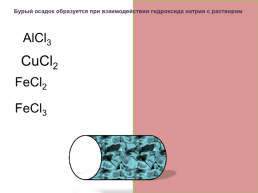
Бурый осадок образуется при взаимодействии гидроксида натрия с раствором
AlCl3 белый
CuCl2 голубой
FeCl2 светло-зеленый
FeCl3 бурый
Слайд 23
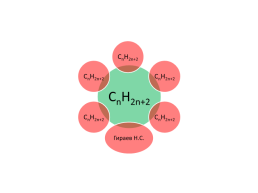
Укажите общую формулу алканов:
CnH2n+2 алканы
CnH2n-2 алкины
CnH2n алкены
CnH2n+1 радикалы
 Решение задач по химической формуле
Решение задач по химической формуле Воспитательные, развивающие и обучающие задачи: в чем разница и как их правильно формулировать
Воспитательные, развивающие и обучающие задачи: в чем разница и как их правильно формулировать Формулы сокращённого умножения 7 класс
Формулы сокращённого умножения 7 класс Разложение на множители с помощью формул квадрата суммы и квадрата
Разложение на множители с помощью формул квадрата суммы и квадрата Урок алгебры в 10 классе «Формулы двойного угла»
Урок алгебры в 10 классе «Формулы двойного угла» Амфотерность химических соединений
Амфотерность химических соединений Роль воды в химических реакциях
Роль воды в химических реакциях